题目内容
15.用NA表示阿伏加德罗常数,下列说法中正确的是( )| A. | 1 molAl3+含有的核外电子数为3NA | |
| B. | 将58.5g NaCl溶于1.00 L水中,所得NaCL溶液的浓度为1.00mol•L-1 | |
| C. | 1 molCl2与足量的铁反应,转移的电子为数3Na | |
| D. | 常温下,10LpH=1的硫酸溶液中含有的H+离子数为NA. |
分析 A.1个铝离子含有10个电子;
B.溶液的体积大于1L;
C.1molCl2和过量Fe反应生成氯化铁,氯气不足,依据氯气的物质的量计算转移电子数;
D.依据pH=-lg[H+]计算氢离子浓度,依据n=CV计算氢离子的物质的量;
解答 解:A.1个铝离子含有10个电子,1 molAl3+含有的核外电子数为10NA,故A错误;
B.将58.5g NaCl溶于1.00 L水中,溶液的体积大于1L,所得NaCL溶液的浓度小于1.00mol•L-1,故B错误;
C.1molCl2和过量Fe反应生成氯化铁,转移2mol电子,转移电子数为2NA个,故C错误;
D.10L pH=1的硫酸溶液中氢离子浓度为0.1mol/L,1L溶液中含有0.1mol氢离子,含有的H+离子数为NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意物质的量浓度中的体积是指溶液的体积,不是溶剂的体积,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
10.下列实验操作或事故处理中,正确的做法是( )
| A. | 氢气中混有一定量的氧气,可通过灼热的铜网来除去氧气 | |
| B. | 用无水硫酸铜检验CO2气体中是否含有水蒸气 | |
| C. | 除去SO2气体中的CO2,将混合气体通过澄清的石灰水 | |
| D. | 工业上将氯气通入澄清石灰水水制漂白粉 |
6.多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素.它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I).
(1)在表中①②③空格处应分别填写氧氰、HSCN、NaOCN.
(2)完成下列反应的化学方程式或离子方程式.
①H++SCN-+MnO2$\stackrel{△}{→}$4H++2SCN-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++(SCN)2↑+2H2O.
②(CN)2和KOH溶液反应的化学方程式为(CN)2+2KOH═KCN+KCNO+H2O
③已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-.试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:(CN)2+2SCN-═2CN-+(SCN)2.
| 卤素 | 氰 | 硫氰 | ① | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | ③ |
(2)完成下列反应的化学方程式或离子方程式.
①H++SCN-+MnO2$\stackrel{△}{→}$4H++2SCN-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++(SCN)2↑+2H2O.
②(CN)2和KOH溶液反应的化学方程式为(CN)2+2KOH═KCN+KCNO+H2O
③已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-.试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:(CN)2+2SCN-═2CN-+(SCN)2.
3.某氮的氧化物是大气污染物之一,在一定温度和有催化剂的条件下,该氧化物与氨气反应只生成氮气和水,若生成的氮气和水的物质的量之比为5:6,该氧化物的化学式为( )
| A. | N2O5 | B. | NO | C. | NO2 | D. | N2O3 |
10.氯化铜晶体(CuCl2•xH2O)是重要的化工原料,可用作催化剂、消毒剂等,用孔雀石[主要含Cu2(OH)2CO3,还含有少量Fe、Si的化合物]制备氯化铜晶体,方案如图:

已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
(1)酸溶时应选择酸的名称为盐酸;若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①可选用BE(填字母).
A.Cu B.Cl2 C.NH3•H2O D.NaOH E.H2O2 F.KMnO4
(2)加入试剂②的目的是调节pH至a,a的范围是3.7~5.4,写出试剂②的一种可能的化学式CuO、Cu(OH)2.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是蒸发浓缩、冷却结晶、过滤、用无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是防止CuCl2•xH2O晶体溶解损失.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是CuCl2•xH2O晶体加热时会发生水解.
②称取ag晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为bg.则x=$\frac{80a-135b}{18b}$(用含a、b的代数式表示).

已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
| 离子种类 pH | Fe3+ | Cu2+ | Fe2+ |
| 开始沉淀 | 2.7 | 5.4 | 8.1 |
| 沉淀完全 | 3.7 | 6.9 | 9.6 |
A.Cu B.Cl2 C.NH3•H2O D.NaOH E.H2O2 F.KMnO4
(2)加入试剂②的目的是调节pH至a,a的范围是3.7~5.4,写出试剂②的一种可能的化学式CuO、Cu(OH)2.由溶液C获得CuCl2•xH2O,包含4个基本实验操作,这4个基本实验操作依次是蒸发浓缩、冷却结晶、过滤、用无水乙醇洗涤等操作,使用无水乙醇代替水进行洗涤的主要原因是防止CuCl2•xH2O晶体溶解损失.
(3)为了测定制得的氯化铜晶体(CuCl2•xH2O)中x值,有同学设计了如下两种实验方案:
①称取一定质量的晶体加热使其失去结晶水,称量所得无水CuCl2的质量.该方案存在的问题是CuCl2•xH2O晶体加热时会发生水解.
②称取ag晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀至质量不再减轻为止,称量所得固体的质量为bg.则x=$\frac{80a-135b}{18b}$(用含a、b的代数式表示).
7.请用文字指出下图所示的装置和操作错在哪里,如何改正.
| 装 置 | NaOH溶液的存放 | 固体物质的称量 | 向容量瓶中转移溶液 |
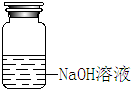 | 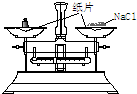 | 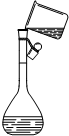 | |
| 错误之处 | 放在了带有磨口玻璃塞的广口瓶中 | 被称量的药品放在右边托盘 | 直接向容量瓶中转移溶液 |
| 如何改正 | 应放在带有橡胶塞的细口瓶中 | 应放在左边托盘中 | 应该用玻璃棒引流 |
4.下列指定反应的离子方程式正确的是( )
| A. | 向漂白粉溶液中通入过量的SO2气体:ClO-+SO2+H2O═HSO3-+HClO | |
| B. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向Fe(NO3) 3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
5.有一空瓶的质量为100g,向该瓶中充满氧气后质量为132g,在相同条件下充满某气体,其质量为171g,则对此气体的叙述错误的是( )
| A. | 该气体的摩尔质量 71 g•mol-1 | |
| B. | 标准况况下2.24 L该气体含电子数为1.7 NA | |
| C. | 将1mol该气体通入足量的NaOH中反应,转移电子数为 NA | |
| D. | 该气体的水溶液具有强氧化性,能杀菌消毒和漂白某些物质 |