13.下列各组物质性质的排列顺序的不正确的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 碱性:KOH>NaOH>Mg(OH)2 | ||
| C. | 熔沸点:HI>HBr>HCl>HF | D. | 稳定性:HF>H2O>H2S |
10. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
(1)①写出工业合成氨的化学方程式N2+3H2$?_{高温高压}^{催化剂}$2NH3.
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad.(填序号)
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
(2)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2(填“>”、“=”或“<”).
②该反应为吸热反应(填“吸热”或“放热”).
(3)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则平衡时CO的转化率为60%,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a molH2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
9.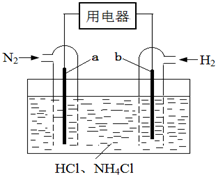 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
8.用下列装置不能达到有关实验目的是( )
0 169556 169564 169570 169574 169580 169582 169586 169592 169594 169600 169606 169610 169612 169616 169622 169624 169630 169634 169636 169640 169642 169646 169648 169650 169651 169652 169654 169655 169656 169658 169660 169664 169666 169670 169672 169676 169682 169684 169690 169694 169696 169700 169706 169712 169714 169720 169724 169726 169732 169736 169742 169750 203614
| A. | 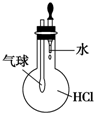 验证HCl的溶解性 | B. | 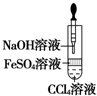 制备Fe(OH)2 | ||
| C. | 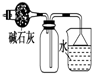 干燥并收集NH3 | D. | 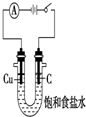 利用电解法制H2和Cl2 |
 .
.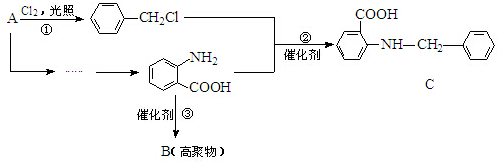
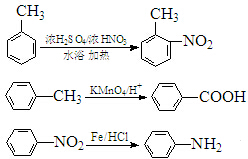 (弱碱,易被氧化)
(弱碱,易被氧化) .
.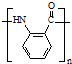 ;反应③的有机反应类型:缩聚反应.
;反应③的有机反应类型:缩聚反应. 水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式:
水解产物的同分异构体,且遇氯化铁溶液发生显色反应,写出X所有的可能结构简式: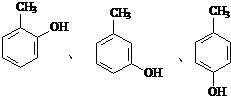 .
.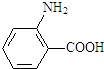 →B
→B 等.
等.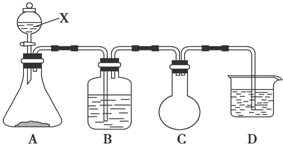
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.