题目内容
14.“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请你回答以下问题:(1)无机非金属材料,高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
SiO2$→_{高温}^{①C}$Si(粗)$→_{300℃}^{②HCl}$SiHCl3$→_{1000℃-1100℃}^{③过量H_{2}}$Si(纯)
①写出步骤①的化学方程式SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑.
②步骤②经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3的主要化学操作的名称是蒸馏或分馏;SiHCl3和SiCl4一样遇水可发生剧烈水解,已知SiHCl3水解会生成两种气态产物,请写出其水解的化学方程式SiHCl3+3H2O═H2SiO3+H2↑+3HCl.
③请写出二氧化硅与氢氟酸反应的化学方程式SiO2+4HF═SiF4↑+2H2O.
(2)磁性材料.这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的防护.最常见的铁制品腐蚀就是电化学腐蚀,请出最为普遍的电化学腐蚀的负极反应式Fe→Fe2++2e-.
(3)激光材料.我国是激光技术先进的国家,红宝石(Al2O3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-+3H2O═2[Al(OH)4]-.
(4)纳米材料.胶体是一种物质以“纳米”颗粒的形式分散到另一种物质里形成的分散系,胶体粒子的直经大约是1nm~100nm,三氯化铁溶液可以加速伤口止血,请简述原因氯化铁是电解质,使血液胶体聚沉.
(5)高分子材料.可以分成无机高分子材料和有机高分子材料.一种新型高效净水剂
[AlFe(OH)nCl6-n]m就属于无机高分子材料,广泛应用于生活用水和工业污水处理,其中铁元素的化合价为+3价.一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH2=CH-CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式
 .
.
分析 (1)①二氧化硅与碳反应生成一氧化碳和硅;
②分离沸点不同的相互溶解的液体可以使用蒸馏法;SiHCl3水解生成硅酸、氢气和氯化氢;
③二氧化硅与氢氟酸反应生成四氟化硅和水;
(2)铁制品发生的电化学腐蚀中,金属铁作负极发生氧化反应;
(3)两性氧化物是指:既能够与酸又能够与碱反应,生成产物都是盐和水;
(4)胶体的分散质微粒直径介于1nm~100nm之间,可溶性电解质溶液能使胶体聚沉;
(5)依据化合物中各元素化合价代数和为0判断铁的化合价;丙烯腈(CH2=CH-CN)中的双键能发生加聚反应.
解答 解:(1)①二氧化硅与碳高温下反应生成硅和一氧化碳,方程式:SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑;
故答案为:SiO2+2C$\frac{\underline{\;\;△\;\;}}{\;}$Si+2CO↑;
②依据题意可知:经过冷凝得到的SiHCl3(沸点33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),利用物质沸点不同,可以通过蒸馏或者分馏的方法分离提纯SiHCl3,SiHCl3水解生成硅酸、氢气和氯化氢,反应方程式为:SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑,
故答案为:蒸馏或分馏;SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑;
③氧化硅与氢氟酸反应生成四氟化硅和水,方程式:SiO2+4HF═SiF4↑+2H2O;
故答案为:SiO2+4HF═SiF4↑+2H2O;
(2)在铁制品的电化学腐蚀中,金属铁作负极发生氧化反应,电极反应为:Fe→Fe2++2e-,
故答案为:Fe→Fe2++2e-;
(3)氧化铝与盐酸反应生成氯化铝和水,方程式:Al2O3+6H+═2Al3++3H2O;氧化铝与碱反应生成四羟基合铝酸钠,方程式:Al2O3+2OH-+3H2O═2[Al(OH)4]-;
故答案为:Al2O3+6H+═2Al3++3H2O、Al2O3+2OH-+3H2O═2[Al(OH)4]-;
(4)胶体的分散质微粒直径范围:1nm~100nm,胶体聚沉的条件:加热、搅拌、加入电解质等,氯化铁是电解质,能使血液胶体聚沉而止血,
故答案为:1nm~100nm;氯化铁是电解质,使血液胶体聚沉;
(5)[AlFe(OH)nCl6-n]m中铝元素显+3价,氢氧根为-1价,各元素的化合价代数和为0,故铁元素的化合价为+3价,丙烯腈(CH2=CH-CN)中的双键能发生加聚反应,方程式为: ,
,
故答案为:+3; .
.
点评 本题考查了硅的制备和提纯及性质,胶体的性质,两性氧化物的性质,金属的腐蚀与防护,高分子反应,熟悉相关知识即可解答,题目难度不大.

 按如图所示装置选取不同试剂组进行实验,下列实验现象预期和结论均正确的是
按如图所示装置选取不同试剂组进行实验,下列实验现象预期和结论均正确的是| a | b | 实验现象预期 | 结论 | |
| A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
| B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
| C | 生铁 | 饱和NaCl溶液 | 导管中发生倒吸 | 生铁发生吸氧腐蚀 |
| D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁做催化剂 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 89.6mL | B. | 112mL | C. | 224 mL | D. | 448mL |
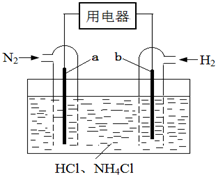 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
| A. | 它不能燃烧 | |
| B. | 它能使酸性高锰酸钾溶液褪色 | |
| C. | 它是一种高分子纯净物 | |
| D. | 它的单体与家用保鲜膜塑料的单体相同 |
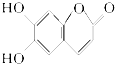
| A. | M的摩尔质量是180g/mol | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | 1 mol M与足量NaHCO3反应能生成4 mol CO2 | |
| D. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |