8.下列气体既易溶于水并且水溶液显碱性的是( )
| A. | NH3 | B. | HCl | C. | SO2 | D. | CH4 |
7.在研究有机历程时,常用816O作为示踪原子.816O的原子核内中子数是( )
| A. | 8 | B. | 18 | C. | 10 | D. | 28 |
5.亚磷酸(H3PO3)是二元弱酸,且具有较强还原性.下列说法正确的是( )
| A. | Na2HPO3溶液显碱性,说明HPO32-的电离程度大于水解程度 | |
| B. | 25℃时,将0.1 mol•L-1的亚磷酸溶液加水稀释后,n(H+)与n(OH-)的乘积不变 | |
| C. | 利用H3PO3进行化学镀银,当参加反应的$\frac{n(A{g}^{+})}{n({H}_{3}P{O}_{3})}$=2时,氧化产物为H3PO4 | |
| D. | NaH2PO3溶液显酸性,其溶液中存在的粒子浓度关系:c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-) |
4.化学与生产、生活密切相关.下列叙述正确的是( )
| A. | 使用含有氯化钠的融雪剂会加快桥梁的腐蚀 | |
| B. | “海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化 | |
| C. | 煤经过气化、液化等物理变化可得到清洁燃料 | |
| D. | 棉花、羊毛、木材和草类的主要成分都是纤维素 |
3.下列有关仪器和操作的说法正确的是( )
| A. | 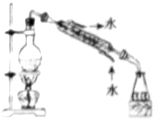 分离Na2CO3溶液和CH3COOC2H5 | B. |  实验室制取少量氨气 | ||
| C. | 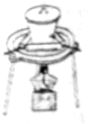 高温煅烧石灰石 | D. | 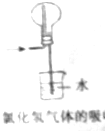 实验室吸收HCl气体 |
1.设NA为阿伏伽德罗常数的数值.下列叙述正确的是( )
| A. | 标况下11.2L乙烷分子中所含分子数为0.5NA | |
| B. | 1.8g的NH4+中含有的电子数为0.1NA | |
| C. | 20克氖气所含原子数为0.5NA | |
| D. | 常温常压下,48g O3和O2的混合气体中,含有氧原子数为3NA |
19.设NA为阿伏伽德罗常数,下列叙述正确的是( )
0 168549 168557 168563 168567 168573 168575 168579 168585 168587 168593 168599 168603 168605 168609 168615 168617 168623 168627 168629 168633 168635 168639 168641 168643 168644 168645 168647 168648 168649 168651 168653 168657 168659 168663 168665 168669 168675 168677 168683 168687 168689 168693 168699 168705 168707 168713 168717 168719 168725 168729 168735 168743 203614
| A. | 0.5mol/L K2SO4溶液所含K+数目为NA | |
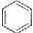
| B. | 标况下22.4L苯所含分子数目为NA | |
| C. | 56gFe与足量盐酸完全反应时,失去电子数目为NA | |
| D. | 常温常压下,16gO2和O3的混合气体所含原子数目为NA |
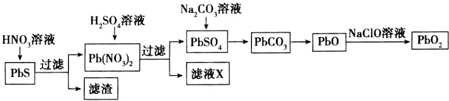
 .
.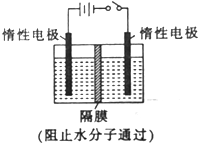 以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.
以NO2为原料可以制得新型绿色硝化剂N2O5,原理是先将NO2转化为N2O4,然后采用电解法制备N2O5,其装置如图所示.