16.对于A2+3B2?2C+D的反应来说,以下化学反应速率的表示中反应速率最快的是( )
| A. | v(A2)=0.4 mol/L•s | B. | v(B2)=0.8mol/L•s | C. | v(C)=0.6 mol/L•s | D. | v(D)=0.1 mol/L•s |
15.下列有关元素的性质及其递变规律正确的是( )
| A. | IA族与ⅦA族元素间可形成共价化合物或离子化合物 | |
| B. | 第二周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 随核电荷数递增,同主族元素的简单阴离子还原性递增减 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
14.某有机物A的结构简式如图所示:下列叙述正确的是( )


| A. | 1molA最多可与4molBr2发生反应 | |
| B. | A分子中含有三类官能团 | |
| C. | 1molA与足量的NaOH反应,最多可以消耗3molNaOH | |
| D. | A的分子式为C13H15O4Cl |
13.同位素示踪法可用于反应机理的研究.下列反应同位素示踪表示正确的是( )
| A. | 2CH3CH2OH+${\;}_{\;}^{18}$O2$→_{□}^{Cu}$2CH3CH${\;}_{\;}^{18}$O+2H2O | |
| B. | CH3COOC2H5+H2${\;}_{\;}^{18}$O$→_{□}^{H+}$CH3COOH+CH3CH2${\;}_{\;}^{18}$OH | |
| C. | 2KMnO4+5H2${\;}_{\;}^{18}$O2+3H2SO4=K2SO4+2KMnSO4+5${\;}_{\;}^{18}$O2↑+8H2O | |
| D. | 2Na2${\;}_{\;}^{18}$O2+2H2O=4Na${\;}_{\;}^{18}$OH+O2↑ |
12.下列物质以任意比例混合,若总物质的量一定,则充分燃烧消耗氧气及生成水的量均相等的是( )
| A. | C2H6,C2H6O | B. | C3H6,C4H6O2 | C. | C2H2,C2H4O | D. | C3H6O,C4H8O2 |
11.下列有机物中,所有原子可能处于同一平面的是( )
| A. | 乙烷 | B. | 甲苯 | C. | 丙炔 | D. | 苯乙烯 |
7.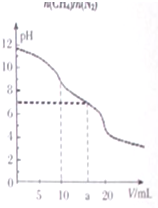 常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
0 167985 167993 167999 168003 168009 168011 168015 168021 168023 168029 168035 168039 168041 168045 168051 168053 168059 168063 168065 168069 168071 168075 168077 168079 168080 168081 168083 168084 168085 168087 168089 168093 168095 168099 168101 168105 168111 168113 168119 168123 168125 168129 168135 168141 168143 168149 168153 168155 168161 168165 168171 168179 203614
 常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,用VmL0.1mol•L-1HCl溶液滴定10.0mL浓度为0.1mol•L-1Na2CO3溶液,所得滴定曲线如图所示.下列说法正确的是( )| A. | 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-) | |
| B. | 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) | |
| C. | 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
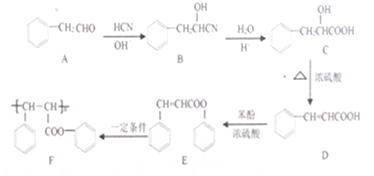
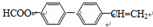
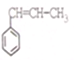 系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.
系统命名为1-苯基丙烯,则D的名称(系统命名)是3-苯基丙烯酸.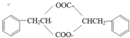 ;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式
;其在相同条件下还可能生成一种高聚酯类化合物,写出该反应的化学方程式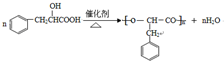 .
. .
.