10. 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
 向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:
向2L的密闭容器中充入7.6mol NO和3.8mol O2,发生如下反应:①2NO(g)+O2(g)?2NO2(g)
②2NO2(g)?N2O4(g)
测得NO2和N2O4的浓度变化如图所示,0~10min维持容器温度为T1℃,10min后升高并维持容器的温度为T2℃.下列说法正确的是( )
| A. | 前5min反应的平均速率v(N2O4)=0.36mol•(L•min)-1 | |
| B. | T1℃时反应②的化学平衡常数K=0.6 | |
| C. | 反应①、②均为吸热反应 | |
| D. | 若起始时向该容器中充入3.6mol NO2和2.0mol N2O4,T1℃达到平衡时,N2O4的转化率为10% |
6.下列有机物命名正确的是( )
| A. |  1,3,4-三甲基苯 1,3,4-三甲基苯 | B. |  2-甲基-1-氯丙烷 2-甲基-1-氯丙烷 | ||
| C. |  2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 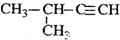 2-甲基-3-丁炔 2-甲基-3-丁炔 |
5.在实验室里,下列除去杂质的方法正确的是( )
①溴苯中混有溴:加入KI溶液,用汽油萃取出溴;
②除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
③硝基苯中混有浓硝酸和浓硫酸:将其倒入浓烧碱溶液中,静置,然后分液;
④乙烯中混有CO2:将其通入浓氢氧化钠溶液洗气后干燥;
⑤除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①溴苯中混有溴:加入KI溶液,用汽油萃取出溴;
②除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
③硝基苯中混有浓硝酸和浓硫酸:将其倒入浓烧碱溶液中,静置,然后分液;
④乙烯中混有CO2:将其通入浓氢氧化钠溶液洗气后干燥;
⑤除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①③⑤ | B. | ②③⑤ | C. | ①④⑤ | D. | ③④⑤ |
4.铝热反应是铝的一个重要性质.某校化学兴趣小组同学,取磁性氧化铁在如图1实验装置进行铝热反应,冷却后得到“铁块”混合物.

(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.
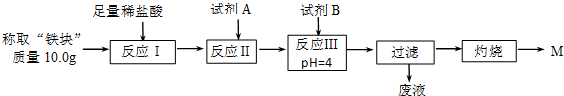
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.

(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为碱式滴定管.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会偏大(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图所示.

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.
3.下表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成. ②球棍模型为 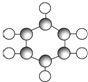 |
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成乙酸乙酯 |
| D | ①由C与HCl浓溶液取代反应生成; ②在不同条件下,D能生成A,也能生成C |
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
(1)A~E中,属于烃的是AB(填字母).
(2)有机物B具有的性质是②③ (填序号).
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(3)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,反应类型为加成反应.
(4)写出D生成A的化学方程式CH3CH2Cl+NaOH$→_{△}^{乙醇}$CH2=CH2+NaCl+H2O反应类型为消去反应.
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是2CH3COOH+Na2CO3=2CH3COONa+CO2↑+H2O(用化学方程式说明).
1.下列物质一定属于同系物的是( )
①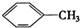 ②
②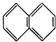 ③
③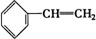 ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦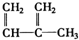 ⑧
⑧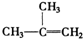
0 167249 167257 167263 167267 167273 167275 167279 167285 167287 167293 167299 167303 167305 167309 167315 167317 167323 167327 167329 167333 167335 167339 167341 167343 167344 167345 167347 167348 167349 167351 167353 167357 167359 167363 167365 167369 167375 167377 167383 167387 167389 167393 167399 167405 167407 167413 167417 167419 167425 167429 167435 167443 203614
①
 ②
② ③
③ ④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦
④C2H4⑤CH2═CH-CH═CH2⑥C3H6⑦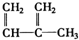 ⑧
⑧
| A. | ①和 ② | B. | ④和⑥ | C. | ⑤和⑦ | D. | ④和⑧ |

 ,名称是3-甲基-1-丁炔;
,名称是3-甲基-1-丁炔;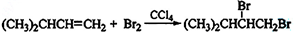 ;
;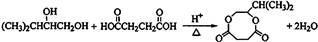 ;
;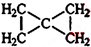 .
. ;(取代反应).
;(取代反应).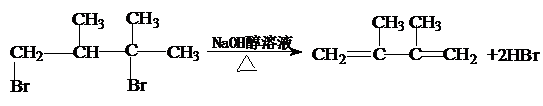 ; (消去反应).
; (消去反应).