碱式碳酸钴[Co4(OH),(CO3)4]常用作电子材料、磁性材料的添加剂,难溶于水,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置(不完整)进行试验。
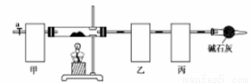
实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)
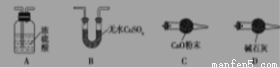
甲: 乙: 丙:
甲装置的作用是 。
(2)步骤②中省略的实验操作为 ;
步骤③中乙装置的现象为 ;
步骤④中缓缓通入空气数分钟的目的是 。
(3)若按正确装置进行实验,测得如下数据。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_____________。
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。
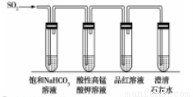
①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。
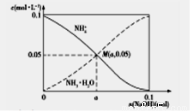
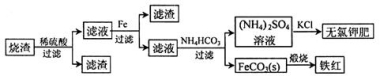
 NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。
NH4HCO3+NH3·H2O,该反应在酸性条件下进行得更彻底。25℃时,向1L0.1molL-1的盐酸中逐渐加入氨基甲酸铵粉末至溶液呈中性(忽略溶液体积变化),共用去0.052mol氨基甲酸铵。若此时溶液几乎不含碳元素,则该溶液中c(NH4+)=____,NH4+水解平衡常数KA=____。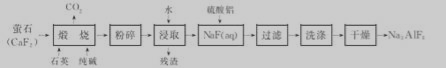
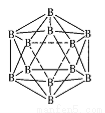
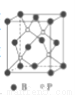
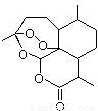
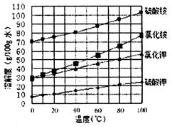
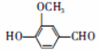 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图: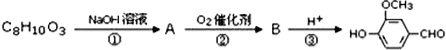
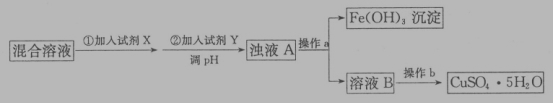
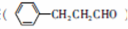 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应: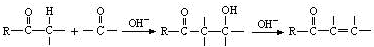
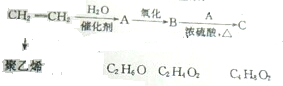
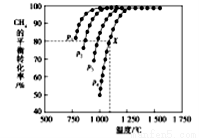
 ,该反应的单体为CH2=CH2,链节为-CH2-CH2-,聚合度为n.
,该反应的单体为CH2=CH2,链节为-CH2-CH2-,聚合度为n.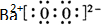 (写电子式),
(写电子式),