7.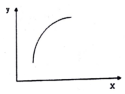 一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(S)+CO(g)?MgO(S)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(S)+CO(g)?MgO(S)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
 一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(S)+CO(g)?MgO(S)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(S)+CO(g)?MgO(S)+CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )| 选项 | x | y |
| A | SO2的浓度 | 平衡常数K |
| B | 温度 | 容器内混合气体的密度 |
| C | CO的物质的量 | CO2与CO的物质的量之比 |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
6.以NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 124 g P4含有P-P键的个数为4NA | B. | 1mol冰中含氢键数为4NA | ||
| C. | 22.4LCH4的分子数为NA | D. | 26g C2H2中有2NA个π键 |
4. 二甲醚又称甲醚,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”.制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1=-283.6kJ•mol-1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
(1)反应③中的相关的化学键键能数据如表:
则△H3=-24kJ•mol-1
(2)下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)原理I中,在恒温、恒容的密闭容器中,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
(4)有人模拟原理II,500K时,在2L的密闭容器中充入2molCO和6molH2,平衡时CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,可逆反应③的平衡常数K3=2.25.在500K时,若容器中n(CH3OH)=n(CH3OCH3),某同学通过计算,得浓度商Qc的值小于K3,则此时反应③中v(正)大于v(逆)(填“大于”或“小于”).
(5)原理II中,为提高二甲醚的产率,可以采取的一种措施是增大压强(或降低温度等).
 二甲醚又称甲醚,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”.制备原理如下:
二甲醚又称甲醚,熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪的清洁燃料”.制备原理如下:I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)?CH3OCH3(g)+H2O(g)△H1=-283.6kJ•mol-1
II.由合成气制备二甲醚:
②CO(g)+2H2(g)?CH3OH(g)△H2=-90.7kJ•mol-1
③2CH3OH(g)?CH3OCH3(g)+H2O(g)△H3
(1)反应③中的相关的化学键键能数据如表:
| 化学键 | C-O | H-O(水) | H-O(醇) | C-H |
| E/(kJ.mol-1) | 343 | 465 | 453 | 413 |
(2)下列能表明反应①达到化学平衡状态的是bd.
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3)原理I中,在恒温、恒容的密闭容器中,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是b.
(4)有人模拟原理II,500K时,在2L的密闭容器中充入2molCO和6molH2,平衡时CO的转化率为80%,c(CH3OCH3)=0.3mol•L-1,可逆反应③的平衡常数K3=2.25.在500K时,若容器中n(CH3OH)=n(CH3OCH3),某同学通过计算,得浓度商Qc的值小于K3,则此时反应③中v(正)大于v(逆)(填“大于”或“小于”).
(5)原理II中,为提高二甲醚的产率,可以采取的一种措施是增大压强(或降低温度等).
3.化学与生产、生活、环境等密切相关.下列说法正确的是( )
| A. | 开发氟氯代烷制冷剂,有利于保护臭氧层 | |
| B. | 绿色食品就是不使用农药,不含任何化学物质的食品 | |
| C. | 推广使用煤液化技术,可减少二氧化碳温室气体的排放 | |
| D. | 使用可降解的无毒聚乳酸塑料代替乙烯作食品包装袋,可减少白色污染 |
2.甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备CH3OH(g).已知某些化学键的键能数据如表:
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,则工业制备CH3OH(g)的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1.
(2)在恒温恒容时,下列说法中能表明上述反应达到平衡状态的有ABD.
A.CO的物质的量不再变化B.v(H2)正=2v(CH3OH)逆
C.混合气体的密度不再变化D.混合气体的平均相对分子质量不再变化
(3)某研究小组在初始投料量相同的条件下,分别在250℃、300℃、350℃模拟以上工业生产进行实验,测定不同温度下CO的平衡转化率与压强的关系如图1所示.(A、B、C分别表示不同温度)

①TC=350℃;KA>KB(填“>”、“<”或“=”)
②实际生产时,通常选择温度为A℃、压强1.3×104kPa左右,选择此压强的理由是此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本.
(4)如图2,常温下,利用甲醇燃料电池电解100mL 0.1食盐水,电解一段时间后,收集到氢气0.224L(已换算成标况下,忽略电解前后溶液体积的变化).
①电解后恢复至常温,U型管中溶液的pH=13(忽略Cl2与NaOH的反应)
②继续电解一段时间,将燃料电池中产生的0.1mol CO2通入到含有0.15mol NaOH的溶液中,则所得溶液中所有离子的浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(1)已知CO中的C与O之间为叁键连接,则工业制备CH3OH(g)的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1.
(2)在恒温恒容时,下列说法中能表明上述反应达到平衡状态的有ABD.
A.CO的物质的量不再变化B.v(H2)正=2v(CH3OH)逆
C.混合气体的密度不再变化D.混合气体的平均相对分子质量不再变化
(3)某研究小组在初始投料量相同的条件下,分别在250℃、300℃、350℃模拟以上工业生产进行实验,测定不同温度下CO的平衡转化率与压强的关系如图1所示.(A、B、C分别表示不同温度)

①TC=350℃;KA>KB(填“>”、“<”或“=”)
②实际生产时,通常选择温度为A℃、压强1.3×104kPa左右,选择此压强的理由是此压强下CO的转化率已较高,再增大压强转化率提高不大且会增加生产成本.
(4)如图2,常温下,利用甲醇燃料电池电解100mL 0.1食盐水,电解一段时间后,收集到氢气0.224L(已换算成标况下,忽略电解前后溶液体积的变化).
①电解后恢复至常温,U型管中溶液的pH=13(忽略Cl2与NaOH的反应)
②继续电解一段时间,将燃料电池中产生的0.1mol CO2通入到含有0.15mol NaOH的溶液中,则所得溶液中所有离子的浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
1.100℃时,Kw=1×10-12.下列三种溶液:①0.01mol/LNH4Cl溶液 ②HCl与NaOH溶液等体积混合,所得pH=6的溶液 ③pH=6.5的NaHCO3溶液.其中呈酸性的是( )
| A. | ① | B. | ③ | C. | ②③ | D. | ①③ |
20.下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 向某溶液加入稀盐酸产生无色气体,将气体通入澄清石灰水后变浑浊 | 该溶液中一定有CO32- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | SiO2可以和NaOH溶液及HF溶液反应 | SiO2属于两性氧化物 |
| D | 氯水可以使有色布条褪色 | 氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
19.室温时,将物质的量浓度相同的稀硫酸与NaOH溶液等体积混合,所得溶液的PH( )
| A. | 大于7 | B. | 小于7 | C. | 等于7 | D. | 无法判断 |
18.用铝制易拉罐收集满CO2,加入过量NaOH浓溶液,立即把口封闭.发现易拉罐“咔咔”作响并变瘪了,过了一会儿,易拉罐又作响并鼓起来,下列有关判断正确的是( )
0 163965 163973 163979 163983 163989 163991 163995 164001 164003 164009 164015 164019 164021 164025 164031 164033 164039 164043 164045 164049 164051 164055 164057 164059 164060 164061 164063 164064 164065 164067 164069 164073 164075 164079 164081 164085 164091 164093 164099 164103 164105 164109 164115 164121 164123 164129 164133 164135 164141 164145 164151 164159 203614
| A. | 导致易拉罐变瘪的离子反应是CO2+OH-═HCO3 | |
| B. | 导致易拉罐又鼓起来的原因是:又生成了二氧化碳气体使得压强增大 | |
| C. | 上述过程中共发生了三个化学反应,且反应结束后的溶液呈碱性 | |
| D. | 若将CO2换为 NH3,浓NaOH溶液换为水,易拉罐也会出现先瘪后鼓的现象 |
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: