4.下列物质中,属于烃的是( )
| A. | CO2 | B. | CH3COOH | C. | Na2CO3 | D. | CH4 |
3.下列关于CH4和CO2的说法正确的是( )
| A. | SiO2属于分子晶体 | |
| B. | CH4分子中含有极性共价键,是极性分子 | |
| C. | 因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2 | |
| D. | CH4和CO2分子中碳原子的杂化类型分别是sp3和sp |
2.下列叙述不正确的是( )
| A. | 在0℃,1.01×105 Pa时,11.2 L氮气所含原子数目为NA | |
| B. | 标准状况下,5.6 L SO3的质量约为20 g | |
| C. | 同温同压下,16 g CH4与44 g CO2具有相同的体积 | |
| D. | 标准状况下,CO和N2的密度相同 |
1.下列有机化学方程式书写正确的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH2Cl2+H2 | |
| B. |  +HO-NO2$→_{△}^{浓硫酸}$ +HO-NO2$→_{△}^{浓硫酸}$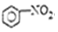 +H2O +H2O | |
| C. | H2C=CH2+Br2→CH3CHBr2 | |
| D. | CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3 |
20.五种短周期主族元素W、X、Y、Z、R的原子序数依次增大,W与X的原子序数之和等于Y 的原子序数,X、Y同周期,Z的单质与冷水能剧烈反应生成W的单质,R的简单离子在同周期元素的简单离子中半径最小,W2Y2常温下为一种液态化合物.下列说法正确的是( )
| A. | 原子半径为W<X<Y<Z<R | |
| B. | 2 mol Z单质投入足量W2Y中,电子转移数为2×6.02×1023 | |
| C. | 电解熔融状态的R的氯化物,可制得R的单质 | |
| D. | W、X、Y三种元素不能组成离子化合物 |
19.向100g水中溶解了22.4L HCl(标准状况下)气体后形成溶液,对该溶液的判断正确的是( )
| A. | 所得溶液的体积为22.5L | |
| B. | 该溶液物质的量浓度为10.00mol•L-1 | |
| C. | 根据题中数据,无法求得该溶液物质的量浓度 | |
| D. | 该溶液中溶质的质量分数因溶液的密度未知而无法求得 |
18.在下列化学反应中,即有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
| A. | 2Na2O2+2H2O=4NaOH+O2↑ | B. | SO2+2H2S=3S+2H2O | ||
| C. | Mg3N2+6H2O=3Mg (OH) 2↓+2NH3↑ | D. | C+O2=CO2 |
16.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 25℃时,1LpH=l的HCl溶液中,由水电离的H+的个数为0.1NA | |
| B. | 25℃时,0.1mol/LNaHCO3溶液中含有HCO3-数小于0.1NA | |
| C. | 标准状况下,NA个H2O分子所占有的体积约为22.4L | |
| D. | lmol(NH4)2Fe(SO4)2•6H2O固体中含有离子总数为5NA |
15.某温度下,将Cl2通入氢氧化钾溶液中,反应后得到KCl、KClO、KCl3的混合溶液,经测定ClO-与ClO3-的物质的量之比为1:2,则Cl2与KOH反应时,被还原的氯原子与被氧化的氯原子的物质的量之比为( )
0 163865 163873 163879 163883 163889 163891 163895 163901 163903 163909 163915 163919 163921 163925 163931 163933 163939 163943 163945 163949 163951 163955 163957 163959 163960 163961 163963 163964 163965 163967 163969 163973 163975 163979 163981 163985 163991 163993 163999 164003 164005 164009 164015 164021 164023 164029 164033 164035 164041 164045 164051 164059 203614
| A. | 11:3 | B. | 10:3 | C. | 4:3 | D. | 2:3 |