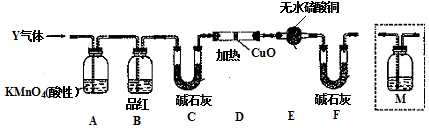
题目内容
2.下列叙述不正确的是( )| A. | 在0℃,1.01×105 Pa时,11.2 L氮气所含原子数目为NA | |
| B. | 标准状况下,5.6 L SO3的质量约为20 g | |
| C. | 同温同压下,16 g CH4与44 g CO2具有相同的体积 | |
| D. | 标准状况下,CO和N2的密度相同 |
分析 A.依据n=$\frac{V}{Vm}$=$\frac{N}{N{\;}_{A}}$计算解答;
B.气体摩尔体积使用对象为气体;
C.依据阿伏伽德罗定律解答;
D.相同条件下,气体密度之比等于摩尔质量之比.
解答 解:A.在0℃,1.01×105 Pa时,11.2 L氮气所含原子数目为$\frac{11.2L}{22.4L/mol}$×2×NA=NA,故A正确;
B.标况下,三氧化硫不是气体,不能使用气体摩尔体积,故B错误;
C.同温同压下,气体摩尔体积相同,16 g CH4与44 g CO2物质的量都是1mol,依据同温同压下,相同体积的任何气体具有相同分子数(物质的量)可知,二者体积相同,故C正确;
D.CO和N2的摩尔质量相同,所以相同条件下,密度相同二者,故D正确;
故选:B.
点评 本题考查了摩尔质量、气体摩尔体积的计算,阿伏伽德罗定律及推论、常用化学计量的有关计算,题目难度不大,明确以物质的量为核心计算公式,熟悉气体摩尔体积使用条件和对象是解题关键.

练习册系列答案
相关题目
5.木糖醇可作口香糖中的甜味剂,可以防止龋齿,其结构简式为如图.下列有关木糖醇的说法错误的是( )


| A. | 木糖醇是醇不是糖 | |
| B. | 1mol木糖醇与钠反应,至多生成56L(标准状况)气体 | |
| C. | 木糖醇能发生取代,氧化,消去等反应 | |
| D. | 木糖醇难溶于水,一定条件下能与乙酸发生酯化反应 |
13.下列电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
7.下列实验操作正确且能达到相应实验目的是( )
| 实验目的 | 实验操作 | |
| A | NaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 配制FeCl3溶液 | 将FeCl3固体溶于适量蒸馏水 |
| C | 检验溶液中是否含NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
| D | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
| A. | A | B. | B | C. | C | D. | D |
14.下列离子方程式书写正确的是( )
| A. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| B. | SO2通入溴水中:SO2+Br2+2H2O═SO42-+2Br-+4H+ | |
| C. | Fe(OH)2溶于过量的稀HNO3:Fe(OH)2+2H+═2Fe2++2H2O | |
| D. | 少量氯水滴入FeBr2溶液中:Cl2+2Br-═2C1-+Br2 |
11.下列变化中属于原电池反应的是( )
| A. | 在空气中金属铝表面迅速氧化形成保护层 | |
| B. | 红热的铁丝与冷水接触,表面形成蓝黑色保护层 | |
| C. | Zn与稀H2SO4反应时,加入少量CuSO4可使反应加快 | |
| D. | KMnO4与H2C2O4反应时,加入少量MnSO4可使反应加快 |

 .
.