17.下列离子方程式的书写中正确的是( )
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氧化铜溶于稀硫酸:CuO+2H+═Cu2++H2O | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
16.下列物质的分类合理的是( )
| A. | 碱性氧化物:Na2O、CaO、Mn2O7、Na2O2 | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3•H2O | |
| D. | 氧化物:CO2、NO、SO2、H2O |
14.下列各组物质的性质比较中,正确的是( )
| A. | 热稳定性:PH3<SiH4<NH3<HF | |
| B. | 微粒直径大小:S2->Cl->Mg2+>Na+ | |
| C. | 酸性强弱:HClO<H2CO3<H2SO3<HBrO4 | |
| D. | 熔点高低:石墨>食盐>干冰>液溴 |
13.半导体工业用石英砂作原料通过三个重要反应生产单质硅.
①SiO2(s)(石英砂)+2C(s)=Si(s)(粗硅)+2CO(g)△H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)=SiCl4(1)△H2=-657.01kJ•mol-1
③SiCl(1)+2Mg(s)=2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为( )
①SiO2(s)(石英砂)+2C(s)=Si(s)(粗硅)+2CO(g)△H=+682.44kJ•mol-1
②Si(s)(粗硅)+2Cl2(g)=SiCl4(1)△H2=-657.01kJ•mol-1
③SiCl(1)+2Mg(s)=2MgCl2(s)+Si(s)(纯硅)△H3=-625.63kJ•mol-1
生产1.00kg纯硅放出的热量为( )
| A. | 24372.86 kJ | B. | 21.44 kJ | C. | 600.20 kJ | D. | 21435.71 kJ |
11.下列说法正确的是( )
| A. | 总质量一定的油脂,无论以何种比例组合,完全水解后生成甘油的量不变 | |
| B. | 用甘氨酸(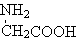 )和丙氨酸( )和丙氨酸( )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 | |
| C. | 用碳酸钠溶液不能区分乙醇、乙酸、苯和硝基苯四种有机物 | |
| D. | 苯酚和苯甲醇互为同系物,均能使酸性高锰酸钾溶液褪色 |
10. 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
①Cu是正极②电子由Zn经外电路流向Cu③负极电极反应为:Zn-2e-=Zn2+ ④溶液中H+向Zn棒迁移.
0 163784 163792 163798 163802 163808 163810 163814 163820 163822 163828 163834 163838 163840 163844 163850 163852 163858 163862 163864 163868 163870 163874 163876 163878 163879 163880 163882 163883 163884 163886 163888 163892 163894 163898 163900 163904 163910 163912 163918 163922 163924 163928 163934 163940 163942 163948 163952 163954 163960 163964 163970 163978 203614
 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )①Cu是正极②电子由Zn经外电路流向Cu③负极电极反应为:Zn-2e-=Zn2+ ④溶液中H+向Zn棒迁移.
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | ①②③④ |
 某气态不饱和链烃CxHy在一定条件下与H2加成为CxHy+m,取CxHy和H2混合气体共120mL进行实验,发现随混合气体中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温间压下测定)由此可知m的数值为( )
某气态不饱和链烃CxHy在一定条件下与H2加成为CxHy+m,取CxHy和H2混合气体共120mL进行实验,发现随混合气体中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温间压下测定)由此可知m的数值为( )