题目内容
12. 某气态不饱和链烃CxHy在一定条件下与H2加成为CxHy+m,取CxHy和H2混合气体共120mL进行实验,发现随混合气体中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温间压下测定)由此可知m的数值为( )
某气态不饱和链烃CxHy在一定条件下与H2加成为CxHy+m,取CxHy和H2混合气体共120mL进行实验,发现随混合气体中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温间压下测定)由此可知m的数值为( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 不饱和烃与氢气恰好反应时,反应后混合气体的总体积最小,由图可知,氢气为80mL时,反应后混合气体体积最小,为40mL,反应前CxHy的体积=120mL-80mL=40mL,相同条件下,气体体积之比等于物质的量之比,根据原子守恒确定n的值.
解答 解:不饱和烃与氢气恰好反应时,反应后混合气体的总体积最小,由图可知,氢气为80mL时,反应后混合气体体积最小,为40mL,反应前CxHy 的体积=120mL-80mL=40mL,故CxHy、H2、CxHy+m的物质的量之比=40mL:80mL:40mL=1:2:1,则反应为:CxHy+2H2$\stackrel{一定条件}{→}$CxHy+m,根据H原子守恒,则m=4,
故选D.
点评 本题以化学反应图象为载体,考查化学方程式的有关计算,为高频考点,侧重考查学生的分析能力和计算能力,关键是明确不饱和烃与氢气恰好反应时反应后混合气体的总体积最小.

练习册系列答案
相关题目
2.下列关于乙醇(C2H5OH)的描述错误的是( )
| A. | 俗称酒精 | B. | 常作溶剂 | ||
| C. | 能与乙酸发生酯化反应 | D. | 不能与金属钠反应 |
3. 短周期主族元素X、Y、Z、T的原子半径与原子序数关系如图所示.X、Z、T均能与Y形成两种常见的化合物.下列推断不正确的是( )
短周期主族元素X、Y、Z、T的原子半径与原子序数关系如图所示.X、Z、T均能与Y形成两种常见的化合物.下列推断不正确的是( )
 短周期主族元素X、Y、Z、T的原子半径与原子序数关系如图所示.X、Z、T均能与Y形成两种常见的化合物.下列推断不正确的是( )
短周期主族元素X、Y、Z、T的原子半径与原子序数关系如图所示.X、Z、T均能与Y形成两种常见的化合物.下列推断不正确的是( )| A. | T元素对应的简单阴离子具有强还原性 | |
| B. | Z与Y形成的两种化合物均为离子化合物 | |
| C. | Z与T形成的化合物的水溶液显碱性 | |
| D. | 元素对应的简单离子的半径Z>T |
20.下列反应的反应热△H>0的是( )
| A. | 铝与稀硫酸反应 | B. | 加热氧化银冶炼银 | ||
| C. | 醋酸与氨水反应 | D. | 液化石油气燃烧 |
7.锶有“金属味精”之称.以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如图:
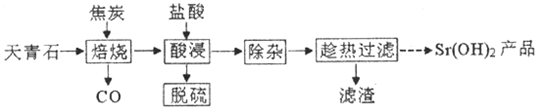
已知氢氧化锶在水中的溶解度:
(1)若隔绝空气焙烧时SrSO4只被还原成SrS,写出焙烧时的化学反应方程式SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.

已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶液度(g/100ml) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.
17.下列离子方程式的书写中正确的是( )
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | 铁与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氧化铜溶于稀硫酸:CuO+2H+═Cu2++H2O | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
13.NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 室温下,lLpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| B. | 标准状况下,2.24LCl2通入水中充分反应,转移电子数目0.1NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,含原子数目为9NA | |
| D. | 氢氧燃料电池正极消耗22.4L (标准状况)气体时,电路中通过的电子数目为2NA |
14.下列反应中,水只做还原剂的是( )
| A. | SO2+H2O→H2SO3 | B. | Cl2+H2O→HCl+HClO | ||
| C. | 2F2+2H2O→4HF+O2 | D. | 2Na+2H2O→2NaOH+H2↑ |