12.下列说法中正确的是( )
| A. | 用分液漏斗分离硬脂酸钠与甘油的混合物 | |
| B. | 容量瓶用蒸馏水洗涤后须烘干才能使用 | |
| C. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| D. | 氯化钠溶液蒸发结晶时,蒸发皿中有大量晶体析出并剩余少量溶液时应停止加热 |
11.下述实验能达到预期目的是( )
| 选项 | 实验内容 | 实验目的 |
| A | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 | 检验Na2SO3晶体是否已氧化变质 |
| B | 向沸水中滴加几滴FeCl3饱和溶液,继续加热至红褐色 | 制备Fe(OH)3胶体 |
| C | 向某溶液中加入稀H2SO4,将产生的气体通入澄清石灰水 | 检验溶液中是否含有CO32- |
| D | 向2mL1mol/L的NaOH溶液中先加入3滴1mol/L的 MgCl2溶液,再加入3滴1mol/L的FeCl3溶液 | 证明Mg(OH)2沉淀可转化为 Fe(OH)3沉淀 |
| A. | A | B. | B | C. | C | D. | D |
10.室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol 的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO4•5H2O 受热分解的化学方程式为:CuSO4•5H2O(s)$\frac{\underline{\;△\;}}{\;}$CuSO4(s)+5H2O(l),热效应为△H3.则下列判断正确的是( )
| A. | △H2>△H3 | B. | △H1>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2<△H3 |
8.下列说法正确的是( )
| A. | (CH3CH2)2CHCH3的系统命名为2-乙基丁烷 | |
| B. | 甲酸(HCOOH)和乙二酸(HOOC-COOH)互为同系物 | |
| C. | 有机物CH3-CH2-NO2和H2N-CH2-COOH是同分异构体 | |
| D. | H2与D2互为同位素 |
7.下列有机物的一氯代物种数最少的是( )
0 163654 163662 163668 163672 163678 163680 163684 163690 163692 163698 163704 163708 163710 163714 163720 163722 163728 163732 163734 163738 163740 163744 163746 163748 163749 163750 163752 163753 163754 163756 163758 163762 163764 163768 163770 163774 163780 163782 163788 163792 163794 163798 163804 163810 163812 163818 163822 163824 163830 163834 163840 163848 203614
| A. |  | B. |  | C. |  | D. | (CH3)2CH(CH2)4CH3 |
 和
和 

 氮氧化物和碳氧化合物的综合治理是当前的重要课题之一.
氮氧化物和碳氧化合物的综合治理是当前的重要课题之一. A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题:
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题: ,F基态原子的外围电子排布式3d104s1.
,F基态原子的外围电子排布式3d104s1.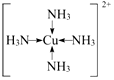 (用元素符号表示).
(用元素符号表示).
 .
. )的一种同分异构体的结构简式
)的一种同分异构体的结构简式 或
或
 $→_{CH_{3}OH}^{H_{2}/Pd}$
$→_{CH_{3}OH}^{H_{2}/Pd}$ 请以CH3OH 和
请以CH3OH 和  为原料制备
为原料制备  ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).