18.原子序数依次增大的短周期元素a、b、c、d,它们的最外层电子数分别依次为6、7、1、3.a、b、c、d形成的简单离子与氖原子电子层结构相同.下列叙述错误的是( )
| A. | d的最高价氧化物对应水化物可溶于c的最高价氧化物对应的水化物的溶液 | |
| B. | a和c形成的离子化合物中可能含有共价键 | |
| C. | 四种元素离子半径:c>d>a>b | |
| D. | c是短周期元素中金属性最强的元素,b是短周期元素中非金属性最强的元素 |
17.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出W的离子结构示意图
(2)比较W与Z的最高价氧化物对应水化物酸性的强弱HClO4>H2SiO3(写化学式)
(3)写出X的氢化物的电子式 ,写出X氢化物的水溶液与X的最高价氧化物对应的水化物的水溶液反应的离子方程式NH3•H2O+H+=NH4++H2O
,写出X氢化物的水溶液与X的最高价氧化物对应的水化物的水溶液反应的离子方程式NH3•H2O+H+=NH4++H2O
(4)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)=2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)=SiO2(s)△H=c kJ•mol-1.写出工业生产中用碳粉还原二氧化硅制取粗硅的热化学方程式2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
| X | ||||
| Y | Z | W |

(2)比较W与Z的最高价氧化物对应水化物酸性的强弱HClO4>H2SiO3(写化学式)
(3)写出X的氢化物的电子式
 ,写出X氢化物的水溶液与X的最高价氧化物对应的水化物的水溶液反应的离子方程式NH3•H2O+H+=NH4++H2O
,写出X氢化物的水溶液与X的最高价氧化物对应的水化物的水溶液反应的离子方程式NH3•H2O+H+=NH4++H2O(4)已知:①C(s)+O2(g)=CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)=2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)=SiO2(s)△H=c kJ•mol-1.写出工业生产中用碳粉还原二氧化硅制取粗硅的热化学方程式2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1.
16.五种短周期主族元素A、B、C、D、E的原子序数依次增大,A2属于绿色燃料,C的氧化物用于生产光导纤维,D元素原子的核电荷数是同主族上一周期元素的2倍,B、C为同周期元素,B、D原子最外层电子数之和等于E的最外层电子数. 根据以上叙述,下列说法中正确的是( )
| A. | 五种元素中有两种金属元素 | |
| B. | 元素C、D、E的最高价氧化物对应水化物的酸性增强 | |
| C. | 元素D、E分别与元素A形成化合物的稳定性:A2D>AE | |
| D. | 元素B、D、E的简单离子半径大小为:B>D>E |
15.“类推”这种思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中错误的是( )
| A. | Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3 | |
| B. | Al(OH)3、Cu(OH)2受热易分解,则Fe(OH)3受热也易分解 | |
| C. | Na可与冷水反应产生氢气,K也可与冷水反应生成氢气 | |
| D. | CO2可以使澄清的石灰水变浑浊,SO2也可以使澄清的石灰水变浑浊 |
14.卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子.以卤块为原料按图所示流程进行生产,可制得轻质氧化镁.

查阅资料得下表相关数据:
*Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽.若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(3)为尽量除去杂质,步骤③调节pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯B.铁三脚C.坩埚D.蒸发皿E.泥三角F.烧杯G.石棉网
(5)向装有少量Mg(OH)2浊液的试管中加入适量CH3COONH4晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),CH3COONH4电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.

查阅资料得下表相关数据:
| 表1:生成氢氧化物沉淀的pH | 表2:原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6 | b.双氧水(含30%H2O2) | 1500 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2200 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 800 |
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的a、c、d(选填试剂编号).
(2)步骤②发生反应的离子方程式为2Fe2++ClO-+2H+=Cl-+2Fe3++H2O;步骤⑤中发生反应的化学方程为MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(3)为尽量除去杂质,步骤③调节pH为9.8时,停止加入Y.调节为该pH的目的是使Mg2+以外的杂质尽可能彻底地转化为沉淀除去.
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是ABCE.
A.酒精喷灯B.铁三脚C.坩埚D.蒸发皿E.泥三角F.烧杯G.石棉网
(5)向装有少量Mg(OH)2浊液的试管中加入适量CH3COONH4晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原因Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),CH3COONH4电离出的NH4+与OH-结合成弱电解质NH3•H2O,降低了c(OH-),Mg(OH)2溶解平衡向右移动.
12.下列有机物命名正确的是( )
| A. |  2-乙基丙烷 2-乙基丙烷 | B. | BrCH2CH2Br 二溴乙烷 | ||
| C. |  间二甲苯 间二甲苯 | D. |  2-甲基-1-丁烯 2-甲基-1-丁烯 |
11.图中各装置,能组成原电池的是( )
| A. |  | B. |  | C. | 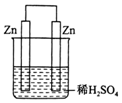 | D. |  |
9.下列物质中,既能发生消去反应又能被氧化成醛的是( )
0 163492 163500 163506 163510 163516 163518 163522 163528 163530 163536 163542 163546 163548 163552 163558 163560 163566 163570 163572 163576 163578 163582 163584 163586 163587 163588 163590 163591 163592 163594 163596 163600 163602 163606 163608 163612 163618 163620 163626 163630 163632 163636 163642 163648 163650 163656 163660 163662 163668 163672 163678 163686 203614
| A. | CH3OH | B. | CH3CH2CH2OH | ||
| C. |  | D. |  |
 依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: