20.某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质.
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是H2(填化学式),写出此过程所发生的2个化学反应方程式:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4 +SO2↑+2H2O、Zn+2H2SO4=ZnSO4 +H2↑.
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)=4.48L.
(3)为证实相关分析,该小组的同学设计了如图1所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收).

①酸性KMnO4溶液的作用是除去二氧化硫气体;B中添加的试剂是浓硫酸.
②装置C中所装药品为CuO,可证实气体X中混有较多量某杂质气体的实验现象是C中黑色粉末变为红色,D中的白色固体变为蓝色.
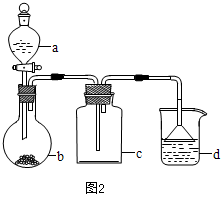
(4)实验室中某些气体的制取、收集及尾气处理装置如图2所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是H2(填化学式),写出此过程所发生的2个化学反应方程式:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4 +SO2↑+2H2O、Zn+2H2SO4=ZnSO4 +H2↑.
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)=4.48L.
(3)为证实相关分析,该小组的同学设计了如图1所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收).

①酸性KMnO4溶液的作用是除去二氧化硫气体;B中添加的试剂是浓硫酸.
②装置C中所装药品为CuO,可证实气体X中混有较多量某杂质气体的实验现象是C中黑色粉末变为红色,D中的白色固体变为蓝色.
(4)实验室中某些气体的制取、收集及尾气处理装置如图2所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是D

| 选项 | a物质 | b物质 | c收集的气体 | d中的物质 |
| A | 浓氨水 | NaOH | NH3 | H2O |
| B | 浓硫酸 | Na2SO3 | SO2 | 澄清石灰水 |
| C | 稀硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | KMnO4 | Cl2 | NaOH溶液 |
19. 如图所示装置中,小试管内为红墨水,U 型管中盛有 pH=4 的雨水和生铁片.经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于 U 型管中的液面.以下有关解释不合理的是( )
如图所示装置中,小试管内为红墨水,U 型管中盛有 pH=4 的雨水和生铁片.经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于 U 型管中的液面.以下有关解释不合理的是( )
 如图所示装置中,小试管内为红墨水,U 型管中盛有 pH=4 的雨水和生铁片.经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于 U 型管中的液面.以下有关解释不合理的是( )
如图所示装置中,小试管内为红墨水,U 型管中盛有 pH=4 的雨水和生铁片.经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于 U 型管中的液面.以下有关解释不合理的是( )| A. | 生铁片中的铁是原电池的负极,发生氧化反应生成Fe2+ | |
| B. | 雨水酸性较强,生铁片开始发生析氢腐蚀 | |
| C. | 墨水液面回升时,正极反应式为:O2+2H2O+4e-=4OH- | |
| D. | 如果将铁片换成铜片,也会出现开始小试管中的导管内的液面下降,一段时间后导管内的液面回 升的现象 |
18.化学中有许多的“守恒或相等”.下列说法不正确的是( )
| A. | 化学反应中,反应物总能量与生成物总能量 | |
| B. | 溶液中,阳离子电荷总数与阴离子电荷总数 | |
| C. | 溶液中,稀释前溶质质量与稀释后溶质质量 | |
| D. | 化学反应中,参加反应物总质量与生成物总质量 |
16.金属铜的提炼多从黄铜矿开始,黄铜矿的熔烧过程主要反应之一为:2CuFeS2+O2=_____+2FeS+SO2,若CuFeS2中Cu、Fe的化合价都为+2,S的化合价为-2.下列说法正确的是( )
| A. | 横线中的物质是Cu2S | B. | CuFeS2仅作还原剂 | ||
| C. | SO2是还原产物,不是氧化产物 | D. | FeS是氧化产物 |
14.在273K和101kPa的条件下,将2.00g氮气,1.40g氮气和1.60g氧气混合,该混合气体的体积是( )
| A. | 6.72L | B. | 7.84L | C. | 10.08L | D. | 13.44L |
13.下列反应不需要加热就能进行的吸热反应是( )
| A. | 碳酸钙分解 | B. | 甲烷在氧气中燃烧 | ||
| C. | 灼热的炭与二氧化碳反应 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
12.在100kPa和298K时,有关反应的热化学方程式有:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-241.8kJ•mol-1;
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H2=-285.8kJ•mol-1
下列说法错误的是( )
| A. | H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 | |
| B. | O2前面的$\frac{1}{2}$表示参加反应的O2的分子数目 | |
| C. | 1mol物质完全燃烧生成稳定氧化物时放出的热为燃烧热,H2的燃烧热为285.8 kJ•mol-1 | |
| D. | 1 mol液态水变成水蒸气时吸收44 kJ的热量 |
11.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
0 163096 163104 163110 163114 163120 163122 163126 163132 163134 163140 163146 163150 163152 163156 163162 163164 163170 163174 163176 163180 163182 163186 163188 163190 163191 163192 163194 163195 163196 163198 163200 163204 163206 163210 163212 163216 163222 163224 163230 163234 163236 163240 163246 163252 163254 163260 163264 163266 163272 163276 163282 163290 203614
| A. | 1 L 0.5 mol•L-1 CH3COOH溶液中所含CH3COO-个数为0.5NA | |
| B. | 在Fe参与的反应中,1 mol Fe失去的电子数为3NA | |
| C. | 14 g 14N所含最外层电子数为5NA | |
| D. | 1 mol 分子中含碳碳双键数为3NA 分子中含碳碳双键数为3NA |
