题目内容
4.下列叙述正确的是( )| A. | NO2、SO2、BF2、NCl3分子中没有一个分子中原子的最外层电子都满足了8e-稳定结构 | |
| B. | CCl4和NH3都是以极性键结合的极性分子,P4和NO2都是共价化合物 | |
| C. | 在CaO和SiO2晶体中,都不存在单个小分子 | |
| D. | π键是由两个p电子“头碰头”重叠形成,σ键是镜面对称,而π键是轴对称 |
分析 A.在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构;
B.CCl4的结构对称,正负电荷的中心重合,P4是单质;
C.CaO和SiO2晶体,分别为离子晶体、原子晶体;
D.π键是由两个p电子以“肩并肩”方式重叠而成,σ键是轴对称,而π键是镜面对称.
解答 解:A.NCl3中所有原子都达到8电子结构,故A错误;
B.CCl4的结构对称,正负电荷的中心重合为非极性分子,NH3是以极性键结合的极性分子,P4是单质而不是化合物,故B错误;
C.CaO和SiO2晶体,分别为离子晶体、原子晶体,所以都不存在单个小分子,故C正确;
D.π键是由两个p电子以“肩并肩”方式重叠而成,σ键是轴对称,而π键是镜面对称,故D错误;
故选C.
点评 本题为小综合,涉及物质的分类、分子的极性和键的极性、晶体类型及构成微粒,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1.6g臭氧中含有氧原子的数目为0.1NA | |
| B. | 6.4g铜片被浓硫酸氧化,失去电子的数目为0.1NA | |
| C. | 标准状况下,11.2LH2O中含水分子的数目为0.5NA | |
| D. | 2 L 0.5 mol•L-1硫酸钾溶液中SO${\;}_{4}^{2-}$离子的数目为2NA |
15.下列关于铝及其化合物的说法中正确的是( )
| A. | Al2O3属于碱性氧化物 | |
| B. | 用烧碱溶液可以去除铁粉中混杂的少量铝粉 | |
| C. | Al(OH)3可治疗胃酸过多,说明铝元素超标对人体无影响 | |
| D. | 铝在空气中耐腐蚀,所以铝是不活泼金属 |
12.下图所示的实验,不能达到实验目的是(各选项中对比溶液的浓度体积均相同)( )
| 实验方案 | 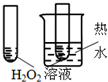 | 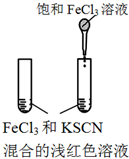 | 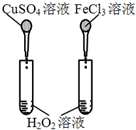 | 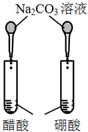 |
| 目的 | A.验证升高温度可加快H2O2分解 | B.验证增大反应物浓度对平衡的影响 | C.比较Cu2+、Fe3+对 H2O2分解速率的影响 | D.比较弱酸的 相对强弱 |
| A. | A | B. | B | C. | C | D. | D |
19.已知巴豆酸的结构简式为CH3-CH=CH-COOH,下列关于巴豆酸的说法,正确的是( )
| A. | 巴豆酸的官能团是:碳碳双键、羧基 | |
| B. | 纯碱溶液、溴水、乙醇、酸高锰酸钾溶液均可与巴豆酸反应 | |
| C. | 巴豆酸的化学式为C4H6O | |
| D. | 巴豆酸与丁酸互为同分异构体 |
9.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.下列有关说法正确的是( )

| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与1molBr2反应 | |
| C. | 此反应为加成反应,羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
16.下列关于有机物的说法正确的是( )
| A. | 聚乙烯可发生加成反应 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 淀粉、纤维素完全水解后的产物相同 | |
| D. | 油脂属于高分子化合物 |
13.2011年,日本发生大地震并引起福岛第一核电站事故,在这国内地大部分地区空气中监测到来自日本核事故释放出的极微量人工放射性核素碘-131.有关$\underset{131}{53}$I叙述不正确的是( )
| A. | 131是这种碘-131的质量数 | B. | $\underset{131}{53}$I与$\underset{127}{53}$I互为同位素 | ||
| C. | 碘-131的中子数为53 | D. | 碘元素在周期表中位于第ⅦA族 |
14.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol Na2O2固体中含有O22- 2NA | |
| B. | 常温常压下,3.2g CH4中含有电子2NA | |
| C. | 标准状况下,11.2L CH3CH2OH中含有分子0.5NA | |
| D. | 100mL 1mol•L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |