题目内容
12.盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂.请回答下列各问:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有强氧化性.
(2)硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜.下列制备方法符合“绿色化学”思想的是③(填序号).
①Cu+HNO3(浓)→Cu(NO3)2
②Cu+HNO3(稀)→Cu(NO3)2
③Cu $→_{△}^{空气}$ CuO $\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2
(3)①在50mL 18mol•L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是B.
A.20.16L B.6.72L C.10.08L D.15.12L
②若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
(4)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水.该反应的化学方程式为Cu+2HCl+H2O2═CuCl2+2H2O.
分析 (1)浓硫酸具有强的氧化性,常温下遇到铁铝发生氧化反应生成致密的氧化膜而被钝化;
(2)“绿色化学”是指:化学反应中没有污染性的物质生成、原子利用率高的反应;
(3)①铜只能和浓硫酸反应和稀硫酸不反应,据此解答;
②硝酸根离子在酸性环境下具有强的氧化性,能够氧化铜生成硝酸铜、一氧化氮和水;
(4)盐酸与铜不反应,加入双氧水后,双氧水与铜反应生成氧化铜,氧化铜与盐酸反应生成氯化铜和水,据此解答.
解答 解:(1)浓硫酸具有强的氧化性,常温下遇到铁铝发生氧化反应生成致密的氧化膜而被钝化,所以可以用铁、铝制的容器盛放浓硫酸;
故答案为:强氧化;
(2)①Cu+HNO3(浓)→Cu(NO3)2,反应产生二氧化氮有毒气体,故不选;
②Cu+HNO3(稀)→Cu(NO3)2,反应生成一氧化氮有毒气体,故不选;
③Cu $→_{△}^{空气}$ CuO $\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2,反应没有有毒气体生成,硝酸全部转化为硝酸铜,原子利用率高考符合“绿色化学”思想,故选;
故选:③;
(3)①铜只能和浓硫酸反应,和稀硫酸不反应,Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O,浓硫酸的物质的量为0.05L×18mol/L=0.9mol,如被还原的硫酸是0.45mol,则生成n(SO2)=0.45mol,V(SO2)=0.45mol×22.4L/mol=10.08L,但随着铜和浓硫酸的反应的进行,酸的浓度越来越小,不再产生二氧化硫,则生成二氧化硫的体积小于10.08L,只有B符合题意;
故答案为:B;
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,加入硝酸钠提供硝酸根离子和溶液中的氢离子形成稀硝酸,稀硝酸可以继续溶解铜,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)盐酸与铜不反应,加入双氧水后,双氧水与铜反应生成氧化铜,氧化铜与盐酸反应生成氯化铜和水,方程式:Cu+2HCl+H2O2═CuCl2+2H2O,
故答案为:Cu+2HCl+H2O2═CuCl2+2H2O.
点评 本题考查了元素化合物知识,侧重考查化学方程式、离子方程式的书写,明确浓硫酸、硝酸的性质是解题关键,注意铜与稀硫酸不反应,题目难度不大.

| A. | 容器内压强不随时间变化 | |
| B. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| C. | 容器内各物质的浓度不随时间变化 | |
| D. | 单位时间消耗0.1molX同时生成0.2molZ |
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1nm~100nm之间 | |
| B. | 用平行光照射CuSO4溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到NaOH溶液中,以制取Fe(OH)3胶体 | |
| D. | 树林中的晨曦,该现象与丁达尔效应有关 |
Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | Na2O2(s)与CO2(g)反应时,放出452kJ热量时,转移电子数为1.204×l023 | |
| B. | CO的燃烧热为△H=-566kJ/mol | |
| C. | CO(g)与Na2O2 (S)反应的热化学方程式为CO(g)+Na2O2(s)═Na2CO3(s)△H=-509kJ/mol | |
| D. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452kJ/mol |
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 四大发明之一黑火药是由硫黄、硝石、木炭三种物质按一定比例混合制成 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 打磨磁石制作指南针为化学变化 |
①是配制一定物质的量的浓度的溶液的专用仪器 ②容量瓶可以用来加热
③使用前要先检查容量瓶是否漏液 ④不能用容量瓶贮存配制好的溶液
⑤可以用500mL容量瓶配制250mL溶液.
| A. | ①和② | B. | ①和⑤ | C. | 除了③ | D. | 除了②⑤ |
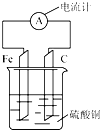 将铁片和碳棒按如图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装置的说法正确的是( )
将铁片和碳棒按如图所示方式插入硫酸铜溶液中,电流计指针发生偏转.下列针对该装置的说法正确的是( )| A. | 铁片是正极 | |
| B. | 一段时间后,碳棒质量增加 | |
| C. | 该装置能将电能转化为化学能 | |
| D. | 外电路中电子由碳棒流出经过电流计流向铁片 |

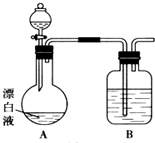 某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.