题目内容
17.已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ/molNa2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
| A. | Na2O2(s)与CO2(g)反应时,放出452kJ热量时,转移电子数为1.204×l023 | |
| B. | CO的燃烧热为△H=-566kJ/mol | |
| C. | CO(g)与Na2O2 (S)反应的热化学方程式为CO(g)+Na2O2(s)═Na2CO3(s)△H=-509kJ/mol | |
| D. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H=-452kJ/mol |
分析 A、依据Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol分析计算判断;
B、依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量分析计算判断;
C、根据盖斯定律利用题给热化学方程式合并消去二氧化碳得到热化学方程式;
D、气态二氧化碳转变成固态要吸热.
解答 解;A、Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol,所以放出452kJ热量时即消耗2molNa2O2,则转移电子数为2moL即1.204×l024,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,单位为KJ/mol,CO的燃烧热为283kJ/mol,故B错误;
C、已知:①2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol ②Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol
,根据盖斯定律合并热化学方程式得到,$\frac{②×2+①}{2}$得到的热化学方程式为 CO(g)+Na2O2(s)=2Na2CO3(s);△H=-509kJ/mol,故C正确;
D、根据热化学方程式为Na2O2+CO2(g)═Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226kJ/mol,又气态二氧化碳转变成固态要吸热,则2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452kJ/mol,故D错误;
故选C.
点评 本题考查了热化学方程式的书写判断,燃烧热的概念应用,反应焓变的意义,盖斯定律的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.把一块生锈的铁片投入盛有稀硫酸溶液的烧杯里,待铁片完全溶解后,往烧杯里滴加氢氧化钠溶液至过量,然后过滤,并充分灼烧不溶物,则最终留下的固体是( )
| A. | Na2O | B. | Fe2O3和Fe | C. | Fe2O3 | D. | Fe2O3和NaOH |
5.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| C. | 7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
6.下列叙述中,正确的是( )
| A. | 1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子 | |
| B. | NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的 | |
| C. | 对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高 | |
| D. | 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 |
7.某同学进行实验研究时,欲配制1.0mol•L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究其原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物可能仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3.
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成.设计实验方案,进行成分检
验.写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管带塞导气管、滴管
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:
①配制250mL约0.1mol•L-1 Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解,将溶液转入250ml的容量瓶中,洗涤,定容,摇匀.
②滴定:准确量取25.00mL所配Ba(OH)2溶液于锥形瓶中,滴加指示剂,将0.1980(填“0.0210”、“0.0536”、“0.1980”或“1.5000”)mol•L-1盐酸装入50mL酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸V mL.
③计算Ba(OH)2•8H2O的质量分数=$\frac{0.25L×\frac{0.198V}{50}mol×315g/mol}{wg}$×100%(只列出算式,不做运算).
(4)室温下,不能(填“能”或“不能”) 配制1.0 mol•L-1 Ba(OH)2溶液.
(1)烧杯中未溶物可能仅为BaCO3,理由是Ba(OH)2•8H2O与CO2作用转化为BaCO3.
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成.设计实验方案,进行成分检
验.写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于试管中,取适量步骤1中的沉淀于试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中. | |
| 步骤4:取适量滤液于烧杯中,用pH计测其 pH值 |
①配制250mL约0.1mol•L-1 Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,溶解,将溶液转入250ml的容量瓶中,洗涤,定容,摇匀.
②滴定:准确量取25.00mL所配Ba(OH)2溶液于锥形瓶中,滴加指示剂,将0.1980(填“0.0210”、“0.0536”、“0.1980”或“1.5000”)mol•L-1盐酸装入50mL酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸V mL.
③计算Ba(OH)2•8H2O的质量分数=$\frac{0.25L×\frac{0.198V}{50}mol×315g/mol}{wg}$×100%(只列出算式,不做运算).
(4)室温下,不能(填“能”或“不能”) 配制1.0 mol•L-1 Ba(OH)2溶液.
 工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.
工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁.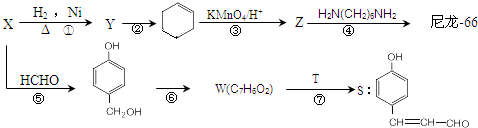
 ,T的分子式为C2H4O.
,T的分子式为C2H4O. .
.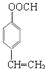 .
.