题目内容
在一密闭容器中,反应mA(g)+nB(g) pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
A.化学计量数:m + n < p B.平衡向逆反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
 pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是
pC(g),达到平时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是A.化学计量数:m + n < p B.平衡向逆反应方向移动了
C.物质B的转化率减小了 D.物质C的质量分数增加了
BC
略

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 CH3OH(g)+H2O(g)+ 49kJ
CH3OH(g)+H2O(g)+ 49kJ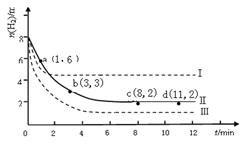

 CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下:
CH3OH(g),经10 min反应达到平衡时测得各组分的浓度如下: 2N2O5(g);
2N2O5(g); ”或“不变”)
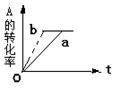
”或“不变”) 2Z(g)此反应达到平衡的标志是
2Z(g)此反应达到平衡的标志是 W+Z,反应速率(V)随时间(t)变化的情况如图所示。
W+Z,反应速率(V)随时间(t)变化的情况如图所示。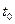 表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是
表示在其他条件不变的情况下,改变体系的一个条件(温度、浓度、压强)所引起的变化。则下列分析正确的是
 的条件是压强,则W、Z均为气体,X、Y中只有一种为气体
的条件是压强,则W、Z均为气体,X、Y中只有一种为气体 体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g)
体混合于容积为2L的某密闭容器中,发生如下反应:3A(g)+ B(g)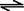 XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
XC(g)+2D(g),2min末反应达到平衡状态,生成0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
 pC(g)+qD (g);H <0有下列判断,其中正确的是
pC(g)+qD (g);H <0有下列判断,其中正确的是 体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p
体积扩大1倍,此时A的浓度变为原来的0.6倍,则m+n<q+p 化
化