题目内容
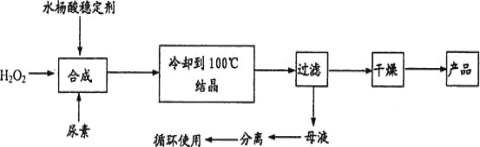
【题目】过碳酸钠(2Na2CO33H2O2)又名过氧碳酸钠,白色颗粒状粉末,其水溶液呈碱性,50℃可分解为碳酸钠和过氧化氢,具有Na2CO3和H2O2的双重性质,是很好的消毒剂、漂白剂、供氧剂。以工业碳酸钠和H2O2为原料制备过碳酸钠的实验装置及步骤:
I.称取10.0g碳酸钠,溶于40mL蒸馏水中,冷却至273K待用。
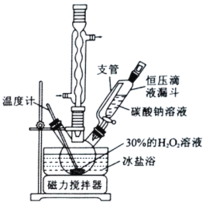
II.量取15mL30%的H2O2溶液加入到三颈烧瓶中,冷却至273K后,加入复合稳定剂,搅拌均匀。
III.在控温及搅拌条件下,将碳酸钠溶液滴入到步骤II的混合液中,待反应液冷却至268K左右,边搅拌边加入4.0gNaCl,静置结晶。
IV.过滤,用无水乙醇洗涤后,真空干燥。
请回答以下问题:
(1)球形冷凝管中回流的主要物质除H2O外还有__________________(填化学式)。
(2)制备过程中涉及的反应及干燥等操作均需在较低温度下进行,原因是________________。
(3)步骤II中加入复合稳定剂的目的之一是与工业碳酸钠中含有的Fe3+生成稳定的配合物,以防Fe3+对制备反应产生不良影响。该不良影响是指__________________________。
(4)步骤IV中完成"过滤”操作所需玻璃仪器有烧杯、____________和____________.
(5)产品中H2O2含量的测定
准确称取产品0.1000g于碘量瓶中,加入50mL蒸馏水,并立即加入6mL2mol·L-1H3PO4溶液,再加入lgKI固体(过量),摇匀后于暗处放置10min,加入适量指示剂,用0.1000rnol·L-1Na2S2O3标准液滴定至终点,消耗Na2S2O3标准溶液17.00mL。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①所加指示剂的名称是____________;确定达到滴定终点的依据是_____________
②若加入KI固体摇匀后未将碘量瓶“在暗处放置10min”,就立即进行滴定操作,测定的结果将会____________(选填“偏大"、“偏小”或“无影响”)。
③根据实验数据计算产品中H2O2的质量分数为____________%。
【答案】H2O2 H2O2和2Na2CO33H2O受热都容易分解,影晌产率 Fe3+催化双氧水的分解使双氧水被消耗 漏斗 玻璃棒 淀粉溶液 滴入最后一滴Na2S2O3标准液.溶液由蓝色变为无色,且30s内不恢复 偏小 28.9
【解析】
(1)加热条件下,H2O和H2O2都会蒸发;
(2)H2O2和2Na2CO33H2O受热都容易分解;
(3)Fe3+会加快双氧水的分解;
(4)"过滤”操作所需玻璃仪器有烧杯、漏斗和玻璃棒;
(5)①碘与淀粉变蓝;碘单质被还原为碘离子时蓝色消失;
②加入KI固体摇匀后,将碘量瓶“在暗处放置10min”,目的是让碘离子与双氧水反应彻底;
③H2O2+2I-+2H+=2H2O+I2、2Na2S2O3+I2=Na2S4O6+2NaI,则H2O2~ I2~2Na2S2O3,根据滴定过程中消耗Na2S2O3的量计算H2O2的物质的量,在计算产品中H2O2的质量分数。
(1)加热条件下,H2O和H2O2都会蒸发,球形冷凝管中回流的主要物质除H2O外还有H2O2;
(2)H2O2和2Na2CO33H2O受热都容易分解,制备过程中涉及的反应及干燥等操作均需在较低温度下进行,提高产率;
(3)步骤II中加入复合稳定剂的目的之一是与工业碳酸钠中含有的Fe3+生成稳定的配合物,以防Fe3+对制备反应产生不良影响。该不良影响是指Fe3+可做催化剂,会加快双氧水的分解,使双氧水被消耗;
(4)"过滤”操作所需玻璃仪器有烧杯、漏斗和玻璃棒;
(5)①测定含量过程中加入KI固体,与双氧水反应生成碘单质,碘与淀粉变蓝,所加指示剂的名称是淀粉溶液;标准液Na2S2O3具有还原性,可将碘单质还原为碘离子,碘单质被消耗完,淀粉恢复原来的颜色,确定达到滴定终点的依据是滴入最后一滴Na2S2O3标准液,溶液由蓝色变为无色,且30s内不恢复;
②加入KI固体摇匀后,将碘量瓶“在暗处放置10min”,目的是让碘离子与双氧水反应:H2O2+2I-+2H+=2H2O+I2,使若加入KI固体摇匀后未将碘量瓶“在暗处放置10min”,就立即进行滴定操作,双氧水为被完全反应,产生的碘单质量减少,消耗标准液的体积减少,测定的结果将会偏小;
③根据滴定过程中的反应:H2O2+2I-+2H+=2H2O+I2、2Na2S2O3+I2=Na2S4O6+2NaI,则H2O2~ I2~2Na2S2O3,滴定时,消耗标准液的物质的量n(Na2S2O3)=17.00×10-3L×0.1000rnol·L-1=1.7×10-3mol,n(H2O2)=![]() n(Na2S2O3)=
n(Na2S2O3)=![]() ×1.7×10-3mol=0.85×10-3mol,则产品中H2O2的质量分数为
×1.7×10-3mol=0.85×10-3mol,则产品中H2O2的质量分数为![]() ×100%=28.9%。
×100%=28.9%。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案【题目】将足量X气体通入Y溶液中,实验结果与预测的现象一致的组合是
X气体 | Y溶液 | 预测的现象 |
| |
① | CO2 | 饱和Na2CO3溶液 | 白色沉淀析出 | |
② | SO2 | Ba(NO3)2溶液 | 白色沉淀析出 | |
③ | Cl2 | AgNO3溶液 | 白色沉淀析出 | |
④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
A. 只有①②③ B. 只有①②④ C. 只有①③④ D. ①②③④