题目内容
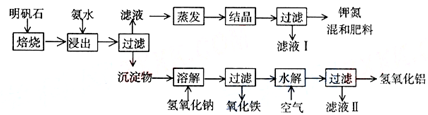
Ⅰ:明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化 铝和少量氧化铁杂质.具体实验步骤如图一所示:
根据图一示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每 升含有250.28g氨)
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+.检验NH4+的方法是
(3)写出沉淀物中所有物质的化学式
(4)滤液I的成分是水和
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量
②
③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
mol(用含m、n的代数式表示).
Ⅱ:某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕 色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失.
请回答下列问题:
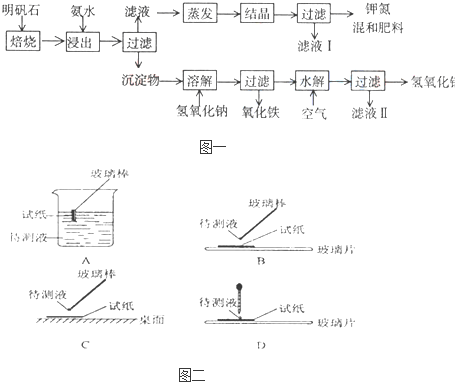
( l )在实验 ①中,图二所示的操作中正确的是
(2)根据上述实验判断原溶液中肯定存在的离子是
(3)写出与②③两个实验有关的离子方程式:
②
③

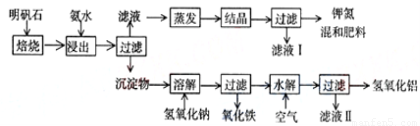
根据图一示,完成下列填空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每 升含有250.28g氨)
78
78
mL,用规格为100
100
mL量筒量取.(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+.检验NH4+的方法是
取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝
取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝
.(3)写出沉淀物中所有物质的化学式
Al(OH)3、Al2O3、Fe2O3
Al(OH)3、Al2O3、Fe2O3
.(4)滤液I的成分是水和
K2SO4、(NH4)2SO4
K2SO4、(NH4)2SO4
.(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量
BaCl2或Ba(NO3)2
BaCl2或Ba(NO3)2
溶液,产生白色沉淀.②
过滤
过滤
、洗涤
洗涤
、干燥
干燥
(依次填写实验操作名称).③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
| (m-132n) |
| 42 |
| (m-132n) |
| 42 |
Ⅱ:某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕 色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失.
请回答下列问题:
( l )在实验 ①中,图二所示的操作中正确的是
BD
BD
(填代号)(2)根据上述实验判断原溶液中肯定存在的离子是
Al3+、NO3-、SO42-
Al3+、NO3-、SO42-
,肯定不存在的离子是Fe3+、Ba2+、HCO3-
Fe3+、Ba2+、HCO3-
.(3)写出与②③两个实验有关的离子方程式:
②
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
;③
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
Al3++3NH3?H2O═Al(OH)3↓+3NH4+
.分析:Ⅰ(1)根据稀释定律计算需要浓氨水的体积,根据要浓氨水的体积选择量筒的规格.为减少误差最好选择比氨水体积大一些的量筒即可.
(2)先铵根离子与强碱反应,转化为氨气,氨气能使湿润的红色石蕊试纸变蓝.
(3)由题目信息可知,明矾石含有Al2O3、Fe2O3.
(4)明矾石的组成和明矾相似,根据工艺流程转化关系可知,滤液I中含有K2SO4和反应生成(NH4)2SO4.
(5)混合肥料中含有K2SO4、(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液;然后进行操作:先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重.
(6)试样为mg,则174n(K2SO4)+132n[(NH4)2SO4]=m,沉淀的物质的量为nmol,即BaSO4的物质的量为nmol,根据硫酸根守恒有:n(K2SO4)+n[(NH4)2SO4]=n.据此计算.
Ⅱ(1)试纸检验溶液的酸碱性时,应用玻璃棒或导管取少量溶液滴在放在玻璃片的试纸上检验.
(2)根据反应的现象判断离子存在的可能性.
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体.
③根据Al(OH)3不溶于弱碱,则在含Al3+溶液中加入氨水只生成Al(OH)3书写离子方程式.
(2)先铵根离子与强碱反应,转化为氨气,氨气能使湿润的红色石蕊试纸变蓝.
(3)由题目信息可知,明矾石含有Al2O3、Fe2O3.
(4)明矾石的组成和明矾相似,根据工艺流程转化关系可知,滤液I中含有K2SO4和反应生成(NH4)2SO4.
(5)混合肥料中含有K2SO4、(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液;然后进行操作:先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重.
(6)试样为mg,则174n(K2SO4)+132n[(NH4)2SO4]=m,沉淀的物质的量为nmol,即BaSO4的物质的量为nmol,根据硫酸根守恒有:n(K2SO4)+n[(NH4)2SO4]=n.据此计算.
Ⅱ(1)试纸检验溶液的酸碱性时,应用玻璃棒或导管取少量溶液滴在放在玻璃片的试纸上检验.
(2)根据反应的现象判断离子存在的可能性.
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体.
③根据Al(OH)3不溶于弱碱,则在含Al3+溶液中加入氨水只生成Al(OH)3书写离子方程式.
解答:解:Ⅰ(1)根据稀释前后溶质的质量不变得:0.5L×39.20g/L=V×250.28g/L,解得V=0.078L=78mL,为减少误差最好选择比氨水体积大一些的量筒即可,故选择100mL量筒.
故答案为:78;100.
(2)取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝,说明有氨气放出,含有NH4+离子.
故答案为:取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝.
(3)由题目信息可知,明矾石的组成和明矾相似,明矾石中含有Al2O3、Fe2O3.所以沉淀有生成的Al(OH)3、及未溶解的 Al2O3、Fe2O3.
故答案为:Al(OH)3、Al2O3、Fe2O3.
(4)明矾石的组成和明矾相似,根据工艺流程转化关系可知,滤液I中含有K2SO4和反应生成(NH4)2SO4.
故答案为:K2SO4、(NH4)2SO4.
(5)混合肥料中含有K2SO4、(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液;然后进行操作:先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重.
故答案为:BaCl2 或Ba(NO3)2;过滤、洗涤、干燥.
(6)试样为mg,则174n(K2SO4)+132n[(NH4)2SO4]=m,沉淀的物质的量为nmol,即BaSO4的物质的量为nmol,根据硫酸根守恒有:n(K2SO4)+n[(NH4)2SO4]=n.联立解得,n(K2SO4)=
mol.
故答案为:
.
Ⅱ(1)A、试纸伸入待测液中,会污染试剂,故A错误;
B、用玻璃棒蘸取少量溶液滴在放在玻璃片的试纸上检验,故B正确;
C、试纸不能放在桌面上,可以放在玻璃片或点滴板上,故C错误;
D、应用导管取少量溶液滴在放在玻璃片的试纸上检验,故D正确.
故答案为:BD.
(2)溶液无色,则一定不存在Fe3+;
①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不会含有Ba2+;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡.
故答案为:一定有Al3+、NO3-、SO42-;一定没有Fe3+、Ba2+、HCO3-.
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
③根据Al(OH)3不溶于弱碱,则在含Al3+溶液中加入氨水只生成Al(OH)3,反应的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+.
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+.
故答案为:78;100.
(2)取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝,说明有氨气放出,含有NH4+离子.
故答案为:取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝.
(3)由题目信息可知,明矾石的组成和明矾相似,明矾石中含有Al2O3、Fe2O3.所以沉淀有生成的Al(OH)3、及未溶解的 Al2O3、Fe2O3.
故答案为:Al(OH)3、Al2O3、Fe2O3.
(4)明矾石的组成和明矾相似,根据工艺流程转化关系可知,滤液I中含有K2SO4和反应生成(NH4)2SO4.
故答案为:K2SO4、(NH4)2SO4.
(5)混合肥料中含有K2SO4、(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液;然后进行操作:先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重.
故答案为:BaCl2 或Ba(NO3)2;过滤、洗涤、干燥.
(6)试样为mg,则174n(K2SO4)+132n[(NH4)2SO4]=m,沉淀的物质的量为nmol,即BaSO4的物质的量为nmol,根据硫酸根守恒有:n(K2SO4)+n[(NH4)2SO4]=n.联立解得,n(K2SO4)=
| (m-132n) |
| 42 |
故答案为:
| (m-132n) |
| 42 |
Ⅱ(1)A、试纸伸入待测液中,会污染试剂,故A错误;
B、用玻璃棒蘸取少量溶液滴在放在玻璃片的试纸上检验,故B正确;
C、试纸不能放在桌面上,可以放在玻璃片或点滴板上,故C错误;
D、应用导管取少量溶液滴在放在玻璃片的试纸上检验,故D正确.
故答案为:BD.
(2)溶液无色,则一定不存在Fe3+;
①用蓝色石蕊试纸检测该溶液,试纸显红色,说明溶液呈酸性,则一定不存在HCO3-;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色,该气体为NO,说明溶液中存在NO3-;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失,说明含有Al3+离子;
④取溶液少许,滴入氯化钡溶液产生白色沉淀,该沉淀为硫酸钡沉淀,说明含有SO42-,则一定不会含有Ba2+;
⑤取实验 ④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失,不能证明是否含有Cl-离子,因④中加入氯化钡.
故答案为:一定有Al3+、NO3-、SO42-;一定没有Fe3+、Ba2+、HCO3-.
(3)②反应为金属铜在酸性条件下与硝酸根离子发生氧化还原反应生成铜离子和一氧化氮气体,反应的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
③根据Al(OH)3不溶于弱碱,则在含Al3+溶液中加入氨水只生成Al(OH)3,反应的离子方程式为Al3++3NH3?H2O═Al(OH)3↓+3NH4+.
故答案为:Al3++3NH3?H2O═Al(OH)3↓+3NH4+.
点评:本题考查学生对工艺流程的理解、离子的检验与共存、物质分离提纯等基本操作、物质性质与化学用语、化学计算等,题目难度中等,本题注意常见离子检验的方法的积累.需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目