题目内容
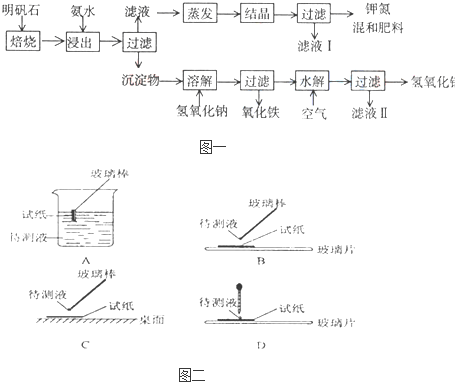
明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质.具体实验步骤如图所示:

根据上述图示,完成下列天空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨) mL,用规格为 mL量筒量取.
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+.检验NH4+的方法是 .
(3)写出沉淀物中所有物质的化学式 .
(4)滤液I的成分是水和 .
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀.
② 、 、 (依次填写实验操作名称).
③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为: mol(用含m、n的代数式表示).

根据上述图示,完成下列天空:
(1)明矾石焙烧后用稀氨水浸出.配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨)
(2)氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的NH4+.检验NH4+的方法是
(3)写出沉淀物中所有物质的化学式
(4)滤液I的成分是水和
(5)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量
②
③冷却、称重.
(6)若试样为mg,沉淀的物质的量为nmol,则试样中K2SO4的物质的量为:
分析:(1)根据溶液稀释过程中溶质的物质的量不变计算出需要浓氨水的体积;根据配制的溶液体积选择容量瓶规格;
(2)检验铵离子方法一般为:向溶液中加入碱溶液,然后加热,利用红色的石蕊试纸检验;
(3)根据题干信息及氨水与铝离子反应生成了氢氧化铝判断沉淀物成分;
(4)明矾石的组成和明矾相似,根据工艺流程转化关系可知,滤液I中含有K2SO4和反应生成(NH4)2SO4;
(5)混合肥料中含有K2SO4、(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液;然后进行操作:先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重;
(6)试样为mg,则174n(K2SO4)+132n[(NH4)2SO4]=m,沉淀的物质的量为nmol,即BaSO4的物质的量为nmol,根据硫酸根守恒有:n(K2SO4)+n[(NH4)2SO4]=n.据此计算.
(2)检验铵离子方法一般为:向溶液中加入碱溶液,然后加热,利用红色的石蕊试纸检验;
(3)根据题干信息及氨水与铝离子反应生成了氢氧化铝判断沉淀物成分;
(4)明矾石的组成和明矾相似,根据工艺流程转化关系可知,滤液I中含有K2SO4和反应生成(NH4)2SO4;
(5)混合肥料中含有K2SO4、(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液;然后进行操作:先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重;
(6)试样为mg,则174n(K2SO4)+132n[(NH4)2SO4]=m,沉淀的物质的量为nmol,即BaSO4的物质的量为nmol,根据硫酸根守恒有:n(K2SO4)+n[(NH4)2SO4]=n.据此计算.
解答:解:(1)配制500mL稀氨水(每升含有39.20g氨),需要使用500mL容量瓶,需要浓氨水(每升含有250.28g氨)的体积为:
≈0.078L=78mL,
故答案为:78;100;
(2)可以使用氢氧化钠和红色石蕊试纸进行检验,具体检验NH4+的方法为:取滤液少许,加入NaOH加热,生成的气体能使润湿的红色石蕊试纸变蓝,
故答案为:取滤液少许,加入NaOH加热,生成的气体能使润湿的红色石蕊试纸变蓝(合理即给分);
(3)明矾石的组成和明矾相似,所以能够与氨水反应生成氢氧化铝沉淀,还含有氧化铝和少量氧化铁杂质不与氨水反应也不容易水,所以沉淀物为:Al(OH)3、Al2O3、Fe2O3,
故答案为:Al(OH)3、Al2O3、Fe2O3;
(4)明矾石的组成和明矾相似,根据工艺流程转化关系可知,滤液I中含有K2SO4和反应生成(NH4)2SO4,
故答案为:K2SO4、(NH4)2SO4;
(5)混合肥料中含有K2SO4、(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液;然后进行操作:先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重,
故答案为:BaCl2 或Ba(NO3)2;过滤、洗涤、干燥.
(6)试样为mg,则174n(K2SO4)+132n[(NH4)2SO4]=m,沉淀的物质的量为nmol,即BaSO4的物质的量为nmol,根据硫酸根守恒有:n(K2SO4)+n[(NH4)2SO4]=n.联立解得,n(K2SO4)=
mol,
故答案为:
.
| 39.20g×0.5L |
| 250.28g |
故答案为:78;100;
(2)可以使用氢氧化钠和红色石蕊试纸进行检验,具体检验NH4+的方法为:取滤液少许,加入NaOH加热,生成的气体能使润湿的红色石蕊试纸变蓝,
故答案为:取滤液少许,加入NaOH加热,生成的气体能使润湿的红色石蕊试纸变蓝(合理即给分);
(3)明矾石的组成和明矾相似,所以能够与氨水反应生成氢氧化铝沉淀,还含有氧化铝和少量氧化铁杂质不与氨水反应也不容易水,所以沉淀物为:Al(OH)3、Al2O3、Fe2O3,
故答案为:Al(OH)3、Al2O3、Fe2O3;
(4)明矾石的组成和明矾相似,根据工艺流程转化关系可知,滤液I中含有K2SO4和反应生成(NH4)2SO4,
故答案为:K2SO4、(NH4)2SO4;
(5)混合肥料中含有K2SO4、(NH4)2SO4,要产生白色沉淀,加入的溶液为BaCl2或Ba(NO3)2溶液;然后进行操作:先将混合液过滤,然后洗涤沉淀,最后干燥,冷却后称重,
故答案为:BaCl2 或Ba(NO3)2;过滤、洗涤、干燥.
(6)试样为mg,则174n(K2SO4)+132n[(NH4)2SO4]=m,沉淀的物质的量为nmol,即BaSO4的物质的量为nmol,根据硫酸根守恒有:n(K2SO4)+n[(NH4)2SO4]=n.联立解得,n(K2SO4)=
| (m-132n) |
| 42 |
故答案为:
| (m-132n) |
| 42 |
点评:本题考查学生对工艺流程的理解、离子的检验与共存、物质分离提纯等基本操作、物质性质与化学用语、化学计算等,题目难度中等,本题注意常见离子检验的方法的积累.需要学生具有扎实的基础知识与灵活运用知识解决问题的能力.

练习册系列答案
相关题目