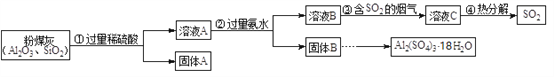
题目内容
【题目】水是生命之源,它与我们的生活密切相关。自来水厂常用高铁酸钠(Na2FeO4)改善水质。高铁酸钠具有很强的氧化性,是一种新型的绿色净水消毒剂,在工业上制备高铁酸钠的方法有多种。
(1)简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_________________________________________________________________________。
(2)干法制备高铁酸钠的反应原理如下:
2FeSO4+6Na2O2==aNa2FeO4+bM↑+2Na2O+2Na2SO4
①高铁酸钠中铁元素的化合价为________________。
②上述方程式中b=____。每生成1molM,该反应转移电子的物质的量为_____________mol。
(3)工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
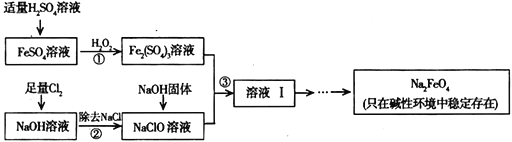
①步骤③中除生成Na2FeO4外,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为____________________________________。
②己知Na2FeO4在强碱性溶液中的溶解度较小。可向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液。从Na2FeO4悬浊液得到固体的操作名称为_____________________。
(4)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_______倍(结果保留两位小数。)
【答案】 高铁酸钠具有很强的氧化性,能杀菌消毒,本身被还原为Fe3+、Fe2+水解生成氢氧化铁胶体能吸附水中的杂质,起到净水作用 +6 1 10 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 过滤 0.64
【解析】(1)高铁酸钠具有强氧化性,可用于杀菌消毒,还原生成Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,可用来除去水中的悬浮物,达到净水的目的,故答案为:FeO42-有强的氧化性,能杀菌消毒,本身被还原为Fe3+,Fe3+发生水解生成氢氧化铁胶体吸附水中的杂质,达到净水的目的;
(2)①钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价,故答案为:+6;
②2FeSO4+6Na2O2==aNa2FeO4+bM↑+2Na2O+2Na2SO4,根据质量守恒,a=2,M为O2,b=1,方程式配平得2FeSO4+6Na2O2═2Na2FeO4+O2↑+2Na2O+2Na2SO4,反应中铁元素化合价升高(6-2)×2=8,过氧化钠中的氧元素化合价升高(1-0)×2=2,化合价降低(2-1)×10=10,即每生成1mol O2,转移电子10mol,故答案为:1;10;
(3)①步骤③是碱溶液中次氯酸根离子氧化铁离子为高铁酸根离子,反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
②从Na2FeO4悬浊液得到固体可以通过过滤实现,故答案为:过滤;
(4)FeO42-+3e-+4H2OFe(OH)3+5OH-,单位质量得到电子![]() =0.018;Cl2+2e-=2Cl-,单位质量得到电子
=0.018;Cl2+2e-=2Cl-,单位质量得到电子![]() =0.028,
=0.028, ![]() =0.64,故答案为:0.64。
=0.64,故答案为:0.64。

 阅读快车系列答案
阅读快车系列答案