题目内容
有三种不同质量比的氧化铜与炭粉的混合物样品①②③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生112 L气体(标准状况),则样品①中氧化铜的质量为___________________g。
(2)乙取样品②a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为______________。样品②中氧化铜质量为___________________g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为_________________________________________。
(1)6.0
(2)C ![]()
(3)![]() mol≤n≤
mol≤n≤![]() mol
mol
解析:(1)1.12 L气体为NO,n(NO)=0.05 mol,由电子守恒:n(Cu)=![]() =0.075 mol,由Cu原子守恒,m(CuO)=0.075 mol×80 g·mol-1=6.0 g。
=0.075 mol,由Cu原子守恒,m(CuO)=0.075 mol×80 g·mol-1=6.0 g。
(2)生成气体不使澄清石灰水变浑浊,说明气体是CO,即C过量,与稀HNO3反应,剩余固体为C,完全反应的CuO与C的质量和为(a-b) g,由CuO+C![]() Cu+CO↑知,
Cu+CO↑知,
m(CuO)=![]() +12 g×(a-b) g=
+12 g×(a-b) g=![]() g
g
(3)若生成气体为CO,则
CuO + C![]() Cu+CO↑ Δm
Cu+CO↑ Δm
80 g 12 g 64 g 28 g
c g
则n(CuO)=![]() mol
mol
若生成气体为CO2,则
2CuO+C![]() 2Cu+CO2↑ Δm
2Cu+CO2↑ Δm
2 mol 44 g
c g
则n(CuO)=![]() mol
mol
即![]() mol≤n≤
mol≤n≤![]() mol
mol




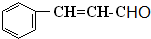



 任意一种.
任意一种.
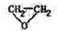
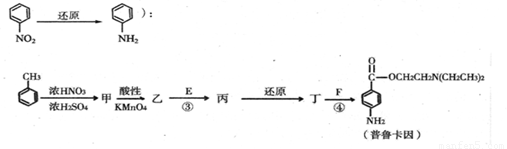
 ):
):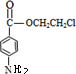
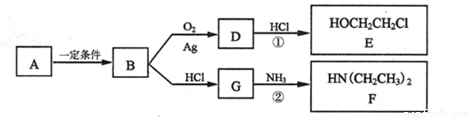
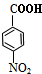 +HOCH2CH2Cl
+HOCH2CH2Cl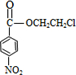 +H2O
+H2O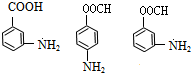
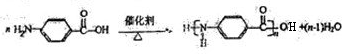

 ):
):