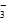题目内容
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)= 4.0molL-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)= 1.0×10-2 molL-1 |
C
试题分析:A、pH=4的醋酸中:c(H+)=10-4molL-1,错误;B、饱和小苏打溶液中,因为HCO3?发生水解反应,所以c(Na+)> c(HCO3-),错误;C、根据电荷守恒,饱和食盐水中离子浓度存在:c(Na+)+ c(H+)= c(Cl-)+c(OH-),正确;D、因为温度为50℃,离子积常数Kw大于1.0×10-14,所以c(OH-)> 1.0×10-2 molL-1,错误。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
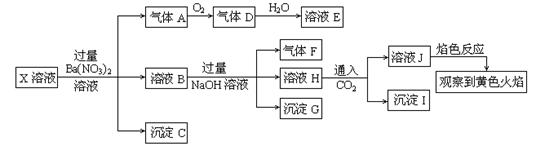
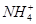 、Cl-、
、Cl-、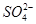 、
、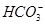 、
、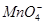 中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是
中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量的Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是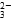 +2I-+4H+
+2I-+4H+ 、NO
、NO