题目内容
室温下,下列说法正确的是
| A.pH=5的NH4Cl溶液或醋酸中,由水电离出的c(H+)均为10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.同体积同pH的氢氧化钠溶液和氨水分别稀释相同倍数,氨水的pH较大 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
C
试题分析:A、醋酸中的c(H+)=10-5mol/L,所以c(OH-)=10-9 mol/L则水电离出的c(H+)为10-9 mol/L,而pH=5的NH4Cl溶液显酸性,是因为铵根离子的水解,pH=5意味着水电离产生的c(H+)=10-5mol/L,错误;B、pH=3的醋酸中c(H+)=1×10-3 mol/L,而c(CH3COOH)>1×10-3 mol/L,pH=11的NaOH溶液c(OH-)=1×10-3 mol/L=c(NaOH)<c(CH3COOH),所以等体积混合,醋酸过量,溶液显酸性,pH<7,错误;C、一水合氨是弱碱,稀释过程中会促进其电离产生氢氧根离子,所以氨水中的氢氧根离子浓度大于氢氧化钠溶液中的氢氧根离子浓度,正确;D、不符合电荷守恒,应为c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-),错误,答案选C。

练习册系列答案
相关题目
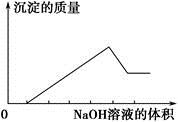
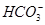 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是