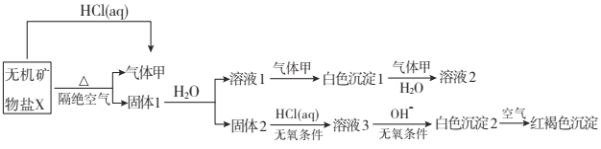
题目内容
【题目】K3[Fe(C2O4)3]· 3H2O(三草酸合铁酸钾晶体)为翠绿色晶体, 溶于水, 难溶于乙醇, 110℃下失去结晶水,230℃分解;是制备负载型活性铁催化剂的主要原料。 实验室利用(NH4)2Fe(SO4)2· 6H2O (硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、30%双氧水等为原料制备三草酸合铁酸钾晶体的部分实验过程如下:
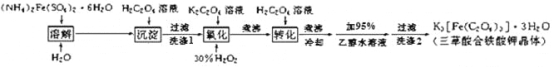
已知:沉淀FeC2O4 · 2H2O 既难溶于水又难溶于强酸
6FeC2O4 + 3H2O2 + 6K2C2O4 = 4K3[Fe(C2O4)3] + 2Fe(OH)3↓
2Fe(OH)3 + 3H2C2O4 + 3K2C2O4 = 2K3[Fe(C2O4)3] + 6H2O
(1)检验硫酸亚铁铵是否变质的试剂是_____;溶解时加几滴稀硫酸的目的是______。
(2)硫酸亚铁铵溶液与 H2C2O4溶液反应生成 FeC2O4 · 2H2O 沉淀,写出该反应方程式_______________;沉淀过滤后,洗涤 1 的操作方法是_______________________________。
(3)在沉淀中加入饱和 K2C2O4 溶液,并用 40 ℃ 左右水浴加热,再向其中慢慢滴加足量的 30% H2O2溶液,不断搅拌。此过程需保持温度在 40 ℃ 左右,可能的原因是_______。加入30%过氧化氢溶液完全反应后,煮沸的目的是______________。
(4)洗涤 2 中所用洗涤试剂最合适的是_______(填选项字母)。
A.草酸钠溶液 B.蒸馏水 C.乙醇 D.KCl溶液
(5)为了不浪费药品,95%乙醇水溶液进行回收的方法是________,所用的主要玻璃仪器有__________(任写两种)等。
【答案】KSCN(或其它合理答案) 抑制Fe2+水解 (NH4)2Fe(SO4)2·6H2O+H2C2O4=FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O
或(NH4)2Fe(SO4)2·6H2O+H2C2O4=FeC2O4·2H2O↓+2NH4HSO4+4H2O 向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作数次 温度太高双氧水容易分解;温度太低反应速率太慢等 除去过量的双氧水 C 蒸馏 蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶任写两种
【解析】
(1)引起硫酸亚铁铵变质的原因是Fe2+易被空气中的氧气氧化为Fe3+,所以检验硫酸亚铁铵是否变质只要检验硫酸亚铁铵溶液中是否存在Fe3+,故所用的试剂是KSCN,若加入KSCN溶液后,溶液变为血红色,就证明含有Fe3+,硫酸亚铁铵变质(或亚铁氰化铁K4[Fe(CN)6],Fe3+与K4[Fe(CN)6]反应生成蓝色沉淀,即普鲁士蓝);硫酸亚铁铵是强酸弱碱盐,Fe2+、NH4+容易水解产生Fe(OH)2、NH3·H2O,使溶液变浑浊,溶解时加几滴稀硫酸的目的是为了抑制Fe2+水解。
(2)硫酸亚铁铵溶液与 H2C2O4溶液反应生成 FeC2O4 · 2H2O 沉淀,反应的方程式为:(NH4)2Fe(SO4)2·6H2O +H2C2O4=FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O或 (NH4)2Fe(SO4)2·6H2O+H2C2O4=FeC2O4·2H2O↓+2NH4HSO4+4H2O;沉淀过滤后,洗涤 1 的操作方法是,向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复操作数次。
(3)在沉淀中加入饱和 K2C2O4 溶液,并用 40 ℃ 左右水浴加热,再向其中慢慢滴加足量的 30% H2O2溶液,不断搅拌,此过程需保持温度在 40 ℃ 左右,可能的原因是:温度过高双氧水容易分解,温度太低反应速率较慢;加入30%过氧化氢溶液完全反应后,煮沸的目的是除去过量的双氧水。
(4)为了减少在洗涤过程中的损失,结合“K3[Fe(C2O4)3]· 3H2O溶于水,难溶于乙醇”,洗涤 2 中所用洗涤试剂最合适的是乙醇,答案选C。
(5)从95%乙醇水溶液中进行回收乙醇的方法是采用蒸馏方法;蒸馏所用的主要玻璃仪器有蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶等。

【题目】氯气是一种重要的工业原料,液氯储存区贴有的说明卡如下:
包装 | 钢瓶 |
储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
泄漏处理 | NaOH、NaHSO3溶液吸收 |
下列解释事实的方程式不正确的是
A. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
B. 电解饱和食盐水制取Cl2:2Cl- +2H2O![]() 2OH-+ H2↑+Cl2↑
2OH-+ H2↑+Cl2↑
C. 浓氨水检验泄露的氯气,产生白烟:8NH3 + 3Cl2 === 6 NH4Cl + N2
D. 氯气“泄漏处理”中NaHSO3溶液的作用:HSO3-+ Cl2 + H2O === SO42-+ 3H+ + 2Cl-
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | 2 | 3 | 1 | 3 |
(1)⑧号元素的在周期表中的位置是________________;上述元素处于同一主族的有_________________。(用元素符号表示)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为8电子的稳定结构,写出其电子式:_________________________(任写一种)。
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_____________________________________________________。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是________。
用作高温堆减速剂。下列说法正确的是________。
A.![]() 和
和![]() 互为同位素B.
互为同位素B.![]() 和
和![]() 属于同种核素
属于同种核素
C.![]() 和
和![]() 的化学性质不同D.
的化学性质不同D.![]() 和
和![]() 是同种物质
是同种物质