题目内容
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)常温下,用0.01mol/L的NaOH溶液滴定10mL0.01mol/L的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

c点时溶液中各离子浓度由大到小的顺序为___;
②b点时溶液中c(N2O22-)___c(H2N2O2)(填“>”“<”或“=”);
(2)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 =___。
=___。
[已知KSP(Ag2SO4)=1.4×10-5、KSP(Ag2N2O2)=5.6×10-9 ]。
(3)常温下,向b mol/L醋酸钠溶液中滴加等体积的amol/L的盐酸,使溶液恰好呈中性,则醋酸的电离平衡常数=___(用含a、b的代数式表示)
【答案】c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+) < 4×10-4 ![]()
【解析】
硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时, Ag2SO4![]() 2Ag++SO42- ,Ag2N2O2
2Ag++SO42- ,Ag2N2O2![]() 2Ag++N2O22-同时达到平衡,溶液中的Ag+浓度相等,分散系中
2Ag++N2O22-同时达到平衡,溶液中的Ag+浓度相等,分散系中 也就是Ag2SO4、Ag2N2O2的溶度积常数之比。
也就是Ag2SO4、Ag2N2O2的溶度积常数之比。
(1)c点时,NaOH与H2N2O2恰好完全反应,生成Na2N2O2和H2O,
在溶液中存在下列转化:
Na2N2O2=2Na++ N2O22-,
N2O22-+H2O![]() HN2O2-+OH-,
HN2O2-+OH-,
HN2O2-+H2O![]() H2N2O2+OH-,
H2N2O2+OH-,
H2O![]() H++OH-
H++OH-
并且转化的趋势依次减小,从而得出各离子浓度由大到小的顺序为
c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+),
答案为:c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-)>c(H+);
②b点时,刚好等摩反应,生成HN2O2-和水,从图中可以看出,此时溶液呈碱性,说明HN2O2-水解趋势大于电离趋势,从而得出溶液中c(N2O22-)<c(H2N2O2),
答案为:<。
(2) =
=![]() ,
,
答案为:4×10-4。
(3)常温下,向b mol/L醋酸钠溶液中滴加等体积的amol/L的盐酸,使溶液恰好呈中性,溶质为醋酸钠和醋酸,所以醋酸钠和盐酸的反应中,醋酸钠是过量的,生成的醋酸的物质的量和HCl的物质的量相等。假设醋酸钠溶液和盐酸的体积均为1L,则生成的醋酸的物质的量为amol,剩余的醋酸钠的物质的量为(b-a)mol,溶液呈中性,所以c(H+)=10-7mol/L,根据电离平衡常数表达式K=![]() ,
,
答案为:![]() 。
。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】某同学用食用油进行实验,以下是实验操作和现象:
实验操作 | 将食用油滴入水中 | 向食用油中滴加溴水 | 将少量食用油与纯碱(主要成分是 |
实验现象 | 食用油浮在水面上 | 溴水褪色 | 分层现象消失 |
下列关于食用油的实验结论不正确的是( )
A.食用油的密度比水小
B.食用油中含碳碳不饱和键
C.食用油在碱性条件下会水解生成可溶于水的物质
D.食用油是一种有机酸
【题目】碳族元素及其化合物广泛存在于自然界中,请回答下列问题:
Ⅰ![]() 锗
锗![]() 是典型的半导体元素,在电子、材料等领域应用广泛。
是典型的半导体元素,在电子、材料等领域应用广泛。
![]() 基态Ge原子的核外电子排布式为
基态Ge原子的核外电子排布式为![]() ______。
______。
![]() 与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因可能是______。
与C是同族元素,C原子之间可以形成双键、三键,但Ge原子之间难以形成双键或三键。从原子结构角度分析,原因可能是______。
![]() 比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因
比较下表中锗卤化物的熔点和沸点,分析其变化规律及原因
|
|
| |
熔点 |
| 26 | 146 |
沸点 |
| 186 | 约400 |
![]() 光催化还原
光催化还原![]() 制备
制备![]() 的反应中,带状纳米
的反应中,带状纳米![]() 是该反应的良好催化剂。Zn、Ge、O的电负性由大至小的顺序是______。Ⅱ
是该反应的良好催化剂。Zn、Ge、O的电负性由大至小的顺序是______。Ⅱ![]() 碳元素的単质有多种形式,其化合物在电子、材料等领域亦应用广泛。
碳元素的単质有多种形式,其化合物在电子、材料等领域亦应用广泛。
![]() 下图所示依次是
下图所示依次是![]() 、石墨和金刚石的结构图。金刚石、石墨烯
、石墨和金刚石的结构图。金刚石、石墨烯![]() 指单层石墨
指单层石墨![]() 中碳原子的杂化形式分别为______、______。
中碳原子的杂化形式分别为______、______。
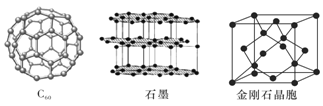
![]() 属于______晶体,石墨属于______晶体。
属于______晶体,石墨属于______晶体。
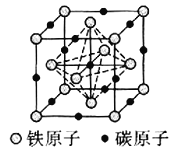
![]() 一种含碳磁性材料的单晶胞结构如图所示。
一种含碳磁性材料的单晶胞结构如图所示。
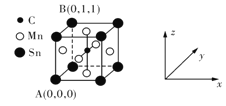
![]() 原子坐标参数表示晶胞内部各原子的相对位置。上图所示晶胞结构中A的原子坐标参数为
原子坐标参数表示晶胞内部各原子的相对位置。上图所示晶胞结构中A的原子坐标参数为![]() 0,
0,![]() ,B为
,B为![]() 1,
1,![]() ,则该晶胞中碳原子的原子坐标为______。
,则该晶胞中碳原子的原子坐标为______。
![]() 在晶体中的堆积方式为______
在晶体中的堆积方式为______![]() 填“简单立方”“体心立方”“面心立方最密”或”六方最密”
填“简单立方”“体心立方”“面心立方最密”或”六方最密”![]() 堆积。
堆积。
![]() 若该晶胞的边长为apm,
若该晶胞的边长为apm,![]() 表示阿伏加德罗常数的值,则该晶体密度的表达式为______。
表示阿伏加德罗常数的值,则该晶体密度的表达式为______。