题目内容
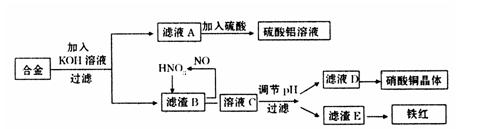
某化学兴趣小组拟用粗氧化铜(含少量铜粉、氧化铁及不溶于酸的杂质)制取
无水氯化铜,其制备步骤如下:
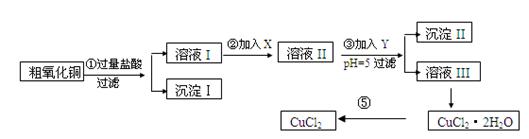
实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
表Ⅱ
请填写下列空白
(1)沉淀Ⅱ的成分(化学式)是 。
(2)步骤②加入的试剂X可选用表Ⅱ中的 (填序号),其作用是 。
(3)步骤③加入的试剂Y可选用表Ⅱ中的 (填序号),控制pH=5的目的是 。
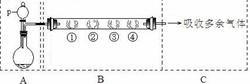
(4)步骤⑤要得到无水CuCl2,应控制的条件是 。
(5)步骤①中所发生的全部反应的离子方程式:
。
无水氯化铜,其制备步骤如下:

实验过程中所用的物质X,Y及pH控制参照下表确定:
表I
| 物质 | 开始沉淀时pH | 完全沉淀时pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 5.2 | 6.4 |
| 氧化剂 | 调节pH的物质 | ||
| A | 双氧水 | D | 氨水 |
| B | 高锰酸钾 | E | 碱式碳酸铜 |
| C | 氯水 | F | 氧化铜 |
(1)沉淀Ⅱ的成分(化学式)是 。
(2)步骤②加入的试剂X可选用表Ⅱ中的 (填序号),其作用是 。
(3)步骤③加入的试剂Y可选用表Ⅱ中的 (填序号),控制pH=5的目的是 。
(4)步骤⑤要得到无水CuCl2,应控制的条件是 。
(5)步骤①中所发生的全部反应的离子方程式:
。
(1)Fe(OH)3
(2)AC 将Fe2+氧化为Fe3+
(3)EF 调节溶液的pH,使Fe3+完全转化为沉淀,而Cu2+不被沉淀
(4)在HCl的气氛中进行脱水
(5)CuO+ 2H+=
Fe2O3+6H+=
Fe3++Cu=
(2)AC 将Fe2+氧化为Fe3+
(3)EF 调节溶液的pH,使Fe3+完全转化为沉淀,而Cu2+不被沉淀
(4)在HCl的气氛中进行脱水
(5)CuO+ 2H+=
Fe2O3+6H+=
Fe3++Cu=
略

练习册系列答案
相关题目
 2HCrO
2HCrO