题目内容
A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是 ( )
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
AC
解析试题分析:由离子带的电荷可知,A、C为非金属元素,B为金属元素,又阳离子B2+和阴离子C-具有相同的电子层结构,则C元素在B的上一周期,A、B在同一个周期,所以可推知原子序数A>B>C,A正确;据元素周期律电子层数越多半径越大,可得原子半径B>C>A,B错误;电子层数相同时核电荷数越大半径反而小,则离子半径A2->C->B2+ ,C正确;原子核外电子数C>A>B,D错误;故选AC。
考点:本题考查的是元素周期表和元素周期律。

练习册系列答案
相关题目
短周期元素X、Y、Z、W、Q在周期表中的相对位置如图所示。下列说法不正确的是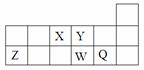
| A.离子半径的大小顺序为W>Q>Y>Z |
| B.X、Y、W三种元素的电负性大小顺序为X>Y>W |
| C.X、Z、W三种元素的最高价氧化物对应的水化物均能与强碱反应 |
| D.元素X的最简单氢化物与Q的氢化物化合的产物中既含共价键又含离子键 |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13,X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是 ( )
| A.由X与Y组成的化合物的沸点总低于由X与Z组成的化合物的沸点 |
| B.元素Z、W 的简单离子的电子层结构不同 |
| C.元素Y 的简单气态氢化物的热稳定性比Z 的强 |
| D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
Rn+离子有m个电子,它的质量数为A,则原子核内的中子数为 ( )
| A.m +n | B.A-m+n | C.A-m-n | D.A+m-n |
2013年2月朝鲜进行了第三次核试验,引起国际社会的极大关注。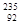 U是一种重要的核燃料,这里的“235”是指该原子的
U是一种重要的核燃料,这里的“235”是指该原子的
| A.质子数 | B.中子数 | C.电子数 | D.质量数 |
实际存在的11H、12H、13H 、H+和H2,它们是
| A.氢的五种同位素 | B.氢元素的五种不同微粒 | C.氢的五种核素 | D.五种氢元素 |
某元素X核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关X的说法中,不正确的是 ( )
| A.X能形成化学式为X(OH)3的碱 |
| B.X能形成化学式为NaXO3的含氧酸钠盐 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X能与某些金属元素或非金属元素形成化合物 |