题目内容
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g) △H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=______________kJ/mol。
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。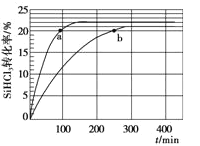
①比较a、b处反应速率大小:υa_____υb(填“>”、“<”、“=”)
②在343 K下:要缩短反应达到平衡的时间,可采取的措施有____。
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K___K343 K(填“>”、“<”、“=”),已知反应速率υ=υ正-υ逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在该温度下当转化率为20%的时刻,υ正/υ逆=________(保留1位小数)。
【答案】-30 > ABD > 2.9
【解析】
(1)根据盖斯定律计算3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H;
(2)根据图示,a点所在的曲线 达到平衡用时少,说明a点所在的曲线温度高;要缩短反应达到平衡的时间,应加快反应速率;
③根据图示,343 K时的平衡转化率是22%,T K时该反应可使SiHCl3的平衡转化率达到30%,说明343 K→T K平衡正向移动;该温度下,反应平衡时υ正=υ逆,根据SiHCl3的平衡转化率为30%,计算![]() 。
。
(1) ①2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g) △H1 = +48kJ/mol;
②4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
根据盖斯定律②-①×3得3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H= +114kJ/mol- 48kJ/mol×3= -30kJ/mol。
(2)①a、b两点的转化率相等,各物质浓度相等, a点所在的曲线温度高,所以反应速率大小:υa>υb;
②A、增大反应物浓度,反应速率加快,能缩短反应达到平衡的时间,故选A;
B、增大压强,反应速率加快,能缩短反应达到平衡的时间,故选B;
C、及时将产物从体系分离,浓度减小,反应速率减慢,能延长反应达到平衡的时间,故不选C;
D、使用更高效的催化剂,反应速率加快,能缩短反应达到平衡的时间,故选D;
③根据图示,343 K时的平衡转化率是22%,T K时该反应可使SiHCl3的平衡转化率达到30%,说明343 K→T K平衡正向移动;所以KT K>K343 K;
该温度下,反应平衡时υ正=υ逆,SiHCl3的平衡转化率为30%,平衡时
2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g)
起始 a 0 0
转化 0.3a 0.15a 0.15a
平衡 0.7a 0.15a 0.15a
k正x2(SiHCl3)= k逆x(SiH2Cl2)x(SiCl4),k正![]() =k逆
=k逆![]() ,
,![]() ;
;
该温度下当转化率为20%的时刻,
2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g)
起始 a 0 0
转化 0.2a 0.1a 0.1a
平衡 0.8a 0.1a 0.1a
υ正/υ逆=![]() 2.9。
2.9。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
k=__________________________。
(3)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在P压强条件下进行,则M点的分压平衡常数KP=________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_______点。
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() ,该温度下在甲、乙、丙、丁四个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
,该温度下在甲、乙、丙、丁四个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 | 丁 |
c(H2)/mol·L-1 | 0.010 | 0.020 | 0.01 | 0.020 |
c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.02 | 0.020 |
下列判断不正确的是
A.平衡时,丙中CO2的转化率小于60%
B.平衡时,甲中和丁中H2的转化率均是60%
C.平衡时,乙中H2和丙中CO2的物质的量浓度相同,均为0.014 mol·L-1
D.平衡时,乙中和丙中CO的体积分数相同