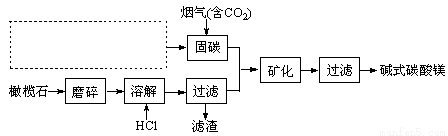
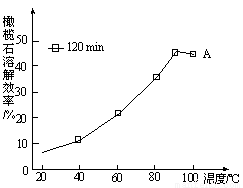
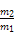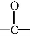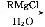题目内容
下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
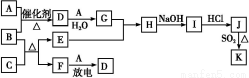
已知:A、F为无色气体单质,B为具有刺激性气味的气体,C为黑色氧化物,E为红色金属单质(部分反应的产物未列出)。请回答下列问题:
(1)D的化学式为 ;F的结构式为 。
(2)A与B反应的化学方程式为 。
(3)E与G的稀溶液反应的离子方程式为 。
(4)B和C反应的化学方程式为 。
(5)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。
(1)NO N≡N
(2)4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)3Cu+8H++2N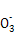
 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
(4)3CuO+2NH3 3Cu+N2+3H2O
3Cu+N2+3H2O
(5)2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++S
2CuCl↓+4H++S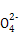
【解析】由已知E为红色金属单质可推知E为Cu,又因为C为黑色氧化物且与B反应生成E(Cu),则知C为CuO。B为具有刺激性气味的气体,则知B为NH3,与CuO可发生反应:3CuO+2NH3 3Cu+N2+3H2O,由此可知F为N2。根据流程图“F(N2)
3Cu+N2+3H2O,由此可知F为N2。根据流程图“F(N2) D”可知A应为O2,D为NO,再结合流程图可顺利推得G为HNO3,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,据此可解答(1)~(4)小题。(5)由于J、K是Cu的不同氯化物,而J为CuCl2,则K只能为CuCl,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O
D”可知A应为O2,D为NO,再结合流程图可顺利推得G为HNO3,H为Cu(NO3)2,I为Cu(OH)2,J为CuCl2,据此可解答(1)~(4)小题。(5)由于J、K是Cu的不同氯化物,而J为CuCl2,则K只能为CuCl,其反应的离子方程式为:2Cu2++2Cl-+SO2+2H2O 2CuCl↓+4H++S
2CuCl↓+4H++S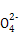 。
。

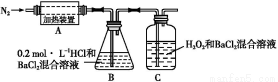
某固体混合物含NH4I、NaHCO3、AlCl3、MgBr2、FeCl2中的几种,为确定该固体混合物的成分及各组成成分的物质的量之比,现进行如下实验。
实验Ⅰ:

(1)无色气体为 。
(2)该固体混合物的成分为 。
实验Ⅱ:取一定量的该固体混合物溶于水配成1 L溶液,并向该混合溶液中通入一定量的Cl2,测得溶液中几种阴离子(分别用A-、B-、C-表示)的物质的量与通入Cl2体积的关系如表所示。
Cl2的体积 (标准状况下)/L | 2.8 | 5.6 | 11.2 |
n(A-)/mol | 1.25 | 1.5 | 2 |
n(B-)/mol | 1.5 | 1.4 | 0.9 |
n(C-)/mol | a | 0 | 0 |
(3)a= 。
(4)原固体混合物中各组成成分的物质的量之比为 。