题目内容
【题目】有下列几组物质,请将序号填入下列空格内:
A、C60和石墨 B、35Cl和37Cl C、![]() 和
和![]()
D、乙醇和甘油 E、CH2=CH-COOH和油酸(C17H33COOH)
①互为同位素的是______________; ②互为同系物的是_________________;
③互为同素异形体的是__________; ④互为同分异构体的是_____________;
【答案】B E A C
【解析】
同位素,质子数相同,中子数不同的核素;同系物,结构相似,分子组成上相差若干个CH2的有机物;同素异形体,有同种元素组成的不同单质;同分异构体,分子式相同结构不同的有机物;
A.C60和石墨是由碳元素组成的不同单质,互为同素异形体;
B.35Cl和37Cl质子数都为17,中子数不同,是氯元素的不同原子,互为同位素;
C.![]() ,分子式相同,结构不同,互为同分异构体;
,分子式相同,结构不同,互为同分异构体;
D.乙醇为一元醇,甘油为丙三醇;
E.CH2=CH-COOH和油酸(C17H33COOH)结构相似、通式相同,相差15个CH2原子团,互为同系物;
根据分析可得,①互为同位素的是B;②互为同系物的是E;③互为同素异形体的是A;④互为同分异构体的是C;

【题目】某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
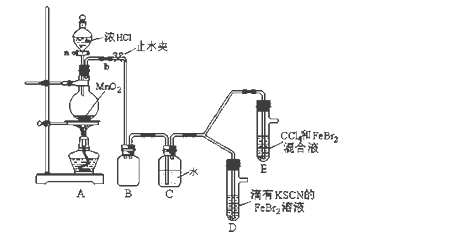
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN-![]() Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________










