题目内容
【题目】二氧化硫的催化氧化是工业上生产硫酸的主要反应,反应如下:
I:2SO2(g)+O2(g)![]() 2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
2SO3(g) △H1=-197.7kJ·mol-1 K1(浓度平衡常数)
为研究该反应,某同学设计了以下三种已装固体V2O3催化剂的密闭容器装置

(1)在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为___________(用“甲、乙、丙”表示)。
(2)在容器丙中,0.1MPa条件下,在不同温度或不同投料方式下研究上述反应得到数据如下表:

①表中:a=___________;b=___________。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=___________;Kp1___________Kp2(填“>”、“<”或“=”)。
③若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,则反应开始时v正(SO2)_______v逆(SO2)(填“>”、“<”或“=”)。
(3)将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H2 K2(浓度平衡常数)
SO3(g)+NO(g) △H2 K2(浓度平衡常数)
Ⅲ:2NO(g)+O2(g)![]() 2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
2NO2(g) △H3=-114.1kJ·mol-1 K3(浓度平衡常数)
△H2=___________;K3=___________(用含有K1、K2的表达式表示)。
【答案】丙>甲>乙 118.62kJ 40% 135MPa-1 > > -41.8 kJ·mol-1 ![]()
【解析】
(1)在初始体积与温度相同的条件下,甲为恒温恒容、乙为绝热恒容、丙为恒温恒压,均按2 mol SO2、1molO2投料,与甲相比,乙中随着反应的进行,温度升高,平衡逆向移动,丙中随着反应的进行,容器的体积逐渐减小,相当于甲平衡后增大压强,平衡正向移动,据此分析判断;
(2) ①根据表格数据,A组起始时充入2 mol SO2、1molO2,平衡转化率为60%,结合2SO2(g)+ O2(g) ![]() 2SO3(g)△H1=-197.7kJ·mol-1,计算平衡时放出的热量a;B组起始时充入2mol SO3,与A组等效,据此判断平衡时三氧化硫的转化率b;
2SO3(g)△H1=-197.7kJ·mol-1,计算平衡时放出的热量a;B组起始时充入2mol SO3,与A组等效,据此判断平衡时三氧化硫的转化率b;
②根据三段式计算平衡时气体的总物质的量,再计算三种物质的物质的量分数,结合压强平衡常数的含义计算K;该反应为放热反应,根据温度对平衡的影响分析判断;
③按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,相当于按0.8 mol SO2、0.6molO2进行投料,与A组等效,结合A组平衡时的各成分的物质的量判断反应的方向;
(3) 根据盖斯定律,![]() ×(I-III)得II,I-II×2得III,据此分析解答。
×(I-III)得II,I-II×2得III,据此分析解答。
(1)在初始体积与温度相同的条件下,甲为恒温恒容、乙为绝热恒容、丙为恒温恒压,均按2 mol SO2、1molO2投料,与甲相比,乙中随着反应的进行,温度升高,平衡逆向移动,SO2的转化率减小;与甲相比,丙中随着反应的进行,容器的体积逐渐减小,相当于甲平衡后增大压强,平衡正向移动,SO2的转化率增大,因此三个容器中SO2的转化率从大到小的顺序为丙>甲>乙,故答案为:丙>甲>乙;
(2) ①根据表格数据,A组起始时充入2 mol SO2、1molO2,平衡转化率为60%,结合2SO2(g)+ O2(g) ![]() 2SO3(g)△H1=-197.7kJ·mol-1,平衡时放出的热量a=197.7kJ×60%=118.62kJ,B组起始时充入2mol SO3,与A组等效,则平衡时三氧化硫的转化率b=1-60%=40%,故答案为:118.62kJ;40%;
2SO3(g)△H1=-197.7kJ·mol-1,平衡时放出的热量a=197.7kJ×60%=118.62kJ,B组起始时充入2mol SO3,与A组等效,则平衡时三氧化硫的转化率b=1-60%=40%,故答案为:118.62kJ;40%;
②A组: 2SO2(g)+ O2(g) ![]() 2SO3(g)
2SO3(g)
起始(mol) 2 1 0
反应(mol) 1.2 0.6 1.2
平衡(mol) 0.8 0.4 1.2
平衡时气体的总物质的量=0.8 mol +0.4 mol +1.2 mol =2.4mol,其中SO2占![]() =
=![]() ,O2占
,O2占![]() =
=![]() ,SO3占
,SO3占![]() =
=![]() ,则Kp1=
,则Kp1=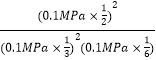 =135MPa-1;该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,Kp1>Kp2,故答案为:135MPa-1;>;
=135MPa-1;该反应为放热反应,升高温度,平衡逆向移动,平衡常数减小,Kp1>Kp2,故答案为:135MPa-1;>;
③A组平衡时n(SO2): n(O2) : n(SO3)=0.8:0.4:1.2=2:1:3。该反应为气体体积减小的反应,若按0.4 mol SO2、0.4molO2、0.4 mol SO3进行投料,相当于按0.8 mol SO2、0.6molO2进行投料,与A组等效,n(SO2): n(O2) : n(SO3)=0.4:0.2:0.4=2:1:2
(3) I:2SO2(g)+O2(g)![]() 2SO3(g) △H1=-197.7kJ·mol-1 K1,
2SO3(g) △H1=-197.7kJ·mol-1 K1,
Ⅱ:SO2(g)+NO2(g)![]() SO3(g)+NO(g) △H2 K2,
SO3(g)+NO(g) △H2 K2,
Ⅲ:2NO(g)+O2(g)![]() 2NO2(g) △H3=-114.1kJ·mol-1 K3,
2NO2(g) △H3=-114.1kJ·mol-1 K3,
根据盖斯定律,将I-II得:2SO2(g)+2NO2(g)![]() 2SO3(g)+2NO(g) 2△H2=(-197.7kJ·mol-1)-(-114.1kJ·mol-1)= -83.6 kJ·mol-1,则△H2= -41.8 kJ·mol-1;
2SO3(g)+2NO(g) 2△H2=(-197.7kJ·mol-1)-(-114.1kJ·mol-1)= -83.6 kJ·mol-1,则△H2= -41.8 kJ·mol-1;
根据盖斯定律,将I-II×2得2NO(g)+O2(g)![]() 2NO2(g),则K3=
2NO2(g),则K3=![]() ,
,
故答案为:-41.8 kJ·mol-1;![]() 。
。

 名校课堂系列答案
名校课堂系列答案