题目内容
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知反应![]() Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)![]()
![]() Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
Fe(s)+ CO2(g) ΔH=-23.5 kJ·mol-1,该反应在
1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1. 0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率=____________
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
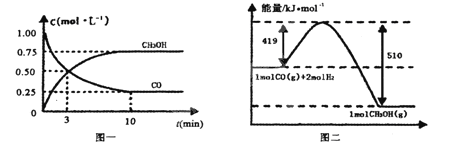
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的 | CH3OH的浓度 | 能量变化 |
甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
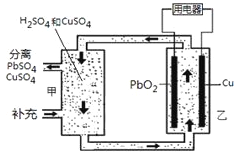
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
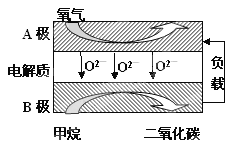
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
【答案】I.(1)60%(2分) (2)d(2分)
Ⅱ.(1)0.15mol/(L·min) (2分)(单位出错给1分)
(2) A D E (3分,有错选不得分)
Ⅲ.(1) CH4+ 4O2——8e—= CO2+ 2H2O;(2分)
(2) 1.12 L(2分)
【解析】试题分析:I.(1)设消耗CO的物质的量是xmol,则生成CO2的物质的量也是xmol,因此平衡时CO和CO2的物质的量分别是1—x和1+x。则 根据平衡常数可知 ,解得x=0.6,则CO的平衡转化率60%。
,解得x=0.6,则CO的平衡转化率60%。
(2)a.正反应是放热反应,升高温度平衡向逆反应方向进行,转化率降低,a错误;b.反应前后体积不变,增大反应体系的压强平衡不移动,转化率不变,b错误;c.催化剂不能改变平衡状态,则选取合适的催化剂不能改变转化率,c错误;d.及时吸收或移出部分CO2,平衡向正反应方向移动,转化率增大,d正确;e.粉碎矿石,使其与平衡混合气体充分接触可以加快反应速率,但不能影响平衡状态,转化率不变,e错误,答案选d。
Ⅱ.(1)根据图像可知反应进行到10min时达到平衡状态,生成甲醇的浓度是0.75mol/L,则根据方程式可知消耗氢气的浓度是1.5mol/L,所以用氢气表示的反应速率为1.5mol/L÷10min=0.15mol/(Lmin)。
(2)A、温度和容器容积相等,则根据表中数据可知甲和乙的平衡是等效的,则c1=c2,A正确;B、丙相当于在甲的基础上再加入1molCO和2mol氢气,压强增大平衡向正反应方向进行,反应物的转化率增大,所以2Q1<Q3,B错误;C、根据B中分析可知2α1不一定等于α3,C错误;D、甲、乙平衡等效,则α1+α2=1,D正确,答案选AD。
Ⅲ.(1)B电极通入甲烷转化为CO2,这说明甲烷被氧化发生氧化反应,则B电极是负极,电极反应式为CH4+4O2﹣﹣8e﹣=CO2+2H2O;
(2)硫酸铜的物质的量是0.1mol,惰性电极电解时阳极是氢氧根放电产生氧气。阴极是铜离子放电析出铜。当铜离子完全放电后氢离子放电产生氢气。当两极收集到的气体体积相等时,这说明阴极有氢气产生。设二者的物质的量均是xmol,则根据电子得失守恒可知0.1×2+2x=4x,解得x=0.1,即阳极产生0.1mol氧气,转移0.4mol电子,所以根据电子转移守恒可知理论上消耗的甲烷的物质的量设0.4mol÷8=0.05mol,在标准状况下的体积为1.12L。