题目内容
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料电池说法正确的是( )
| A.在熔融电解质中,O2-由负极移向正极 |
| B.通入空气的一极是正极,电极反应为:O2+2H2O+4e-=4OH- |
| C.通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-=4CO2+5H2O |
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体为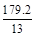 L L |
D
解析

 优学名师名题系列答案
优学名师名题系列答案我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是
| A.此腐蚀过程有化学腐蚀也有电化学腐蚀 |
| B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-=4OH- |
| C.在化学腐蚀过程中有氢气产生 |
| D.发生电化学腐蚀时的负极反应为Fe=Fe2++2e- |
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向。如果电动汽车上使用新型钒电池,一次性充电3—5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的1/25和1/10。全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:
下列有关该钒电池的说法不正确的是:
| A.该电池为可逆电池, 当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 |
| B.放电过程中,右槽溶液中溶液颜色由紫色变为绿色 |
| C.充电过程中, H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 |
D.充电时若转移的电子数为3.01 1023个,左槽溶液中n(H+)增加了0.5mol 1023个,左槽溶液中n(H+)增加了0.5mol |
已知空气-锌电池的电极反应:
锌片:Zn-2OH--2e-=ZnO+H2O,
石墨:1/2O2+H2O+2e-=2OH-
据此推断锌片是( )
| A.负极,被氧化 | B.负极,被还原 |
| C.正极,被氧化 | D.正极,被还原 |
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入( )
| A.0.1 mol CuO | B.0.1 mol CuCO3 |
| C.0.1 mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-=IO+5I-+3H2O,下列说法不正确的是( )
| A.右侧发生的电极反应式:2H2O+2e-=H2↑+2OH- |
| B.电解结束时,右侧溶液中含有IO3— |
C.电解槽内发生反应的总化学方程式:KI+3H2O KIO3+3H2↑ KIO3+3H2↑ |
| D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应不变 |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是( )
| A.由TiO2制得1 mol金属Ti,理论上外电路转移2 mol电子 |
| B.阳极的电极反应式为C+2O2--4e-=CO2↑ |
| C.在制备金属钛前后,整套装置中CaO的总量减少 |
| D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
下列说法正确的是( )
| A.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
| B.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| C.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
| D.电解食盐水一段时间后,可通入一定量的HCl气体来恢复原溶液 |
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+O2=N2+2H2O。下列关于该电池工作时说法中正确的是( )
| A.正极的电极反应式:O2+4H++4e-=2H2O |
| B.溶液中的阴离子向正极移动 |
| C.负极的电极反应式:N2H4+4OH--4e-=4H2O+N2 |
| D.溶液的pH保持不变 |