题目内容
7.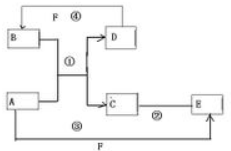 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件均未列出).(1)若A是常见金属单质,与B的水溶液反应生成C和D,D、F是气体单质,D在F中燃烧时发出苍白色火焰.则F所对应的元素在周期表位置是第三周期第ⅦA族,反应②的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
(2)若A、D为短周期元素组成的固体单质,一种为金属,另一种为非金属.且③④两个反应都有红棕色气体生成,则反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
(3)若A、D、F都是短周期非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种重要工业原料气,则1molB中含有4NA个共价键,分子E的结构式是O=C=O.
分析 (1)D、F是气体单质,D在F中燃烧时发出苍白色火焰,应为氢气在氯气的燃烧,则D为H2,F为Cl2,由转化关系可知B为HCl,由反应①②③可知A应为变价金属,则A为Fe,C为FeCl2,E为FeCl3;
(2)A+B=C+D是置换反应,若A、D为短周期元素单质,且A为固体金属单质,D为固体非金属单质,③和④两个反应中都有红棕色气体生成,非金属单质D为C,F为浓硝酸,金属置换非金属单质的反应应为镁和二氧化碳反应生成氧化镁和碳的反应,判断A为Mg,B为CO2,C为MgO,D为C,E为Mg(NO3)2,F为NHO3;
(3)短周期元素同主族元素之间的置换反应有多种,如Na→H2,O2→S,C→Si等,若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种重要工业原料气,则A为C,B为SiO2,D为Si,C为CO,F为O2,E为CO2.
解答 解:(1)D、F是气体单质,D在F中燃烧时发出苍白色火焰,应为氢气在氯气的燃烧,则D为H2,F为Cl2,由转化关系可知B为HCl,由反应①②③可知A应为变价金属,则A为Fe,C为FeCl2,E为FeCl3,F对应的元素为Cl,处于周期表中:第三周期第ⅦA族,反应②的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:第三周期第ⅦA族;2Fe2++Cl2=2Fe3++2Cl-;
(2)A+B=C+D是置换反应,若A、D为短周期元素单质,且A为固体金属单质,D为固体非金属单质,③和④两个反应中都有红棕色气体生成,非金属单质D为C,F为浓硝酸,金属置换非金属单质的反应应为镁和二氧化碳反应生成氧化镁和碳的反应,判断A为Mg,B为CO2,C为MgO,D为C,E为Mg(NO3)2,F为NHO3,反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(3)短周期元素同主族元素之间的置换反应有多种,如Na→H2,O2→S,C→Si等,若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种重要工业原料气,则A为C,B为SiO2,D为Si,C为CO,F为O2,E为CO2.二氧化硅中Si原子与周围的4各个氧原子形成Si-O键,故1mol中SiO2含有4NA个共价键,CO2的结构式为:O=C=O,
故答案为:4NA; O=C=O.
点评 本题考查元素化合物的推断,属于开放性题目,需要学生熟练常见元素化合物的性质,(3)注意二氧化硅的结构,难度中等.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | 苯和己烷(溴水) | B. | 乙醛和丙烯酸(KMnO4溶液) | ||
| C. | 矿物油和植物油(NaOH溶液) | D. | 硝基苯和CCl4(水) |
| A. | 非自发反应一定不能实现 | |
| B. | 同种物质气态时熵值最小,固态时熵值最大 | |
| C. | 恒温恒压下,△H<0且△S>0的反应一定不能自发进行 | |
| D. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| A. | 将2-氯丙烷与NaOH的醇溶液共热制备CH3-CH═CH2 | |
| B. |  与适量NaOH溶液反应制备 与适量NaOH溶液反应制备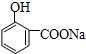 | |
| C. | 用分液法分离苯和液溴的混合物 | |
| D. | 向卤代烃水解后的溶液中直接加入硝酸银溶液,可以确定卤代烃中的卤元素 |
| A. | 相同体积,PH值均为2的盐酸和醋酸分别与NaOH反应,消耗NaOH一样多 | |
| B. | pH=4的醋酸与PH=10的NaOH溶液等体积混合后,PH<7 | |
| C. | 将1 L 0.1 mol•L-1的Ba(OH)2溶液稀释为2 L,pH=12 | |
| D. | pH=8的NaOH溶液稀释100倍,其pH=6 |
(已知某温度下2HI(g)?H2(g)+I2(g)△H=+AkJ•mol-1 K=4.0)
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2 mol HI | 1mol H2+1mol I2 | 2mol HI+1mol H2+1mol I2 |
| HI的浓度 | c1 | c2 | c3 |
| 反应的能量变化 | 吸收akJ | 放出bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
①c1、c3的关系式为2c1=c3
②a、b的关系式为a+b=A
③p2、p3的关系式为2p2=p3
④a1与a2的关系式为α1+α2=1
(2)甲容器中:该反应的平衡常数表达式为K=$\frac{c({H}_{2})•c({I}_{2})}{{c}^{2}(HI)}$.
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟内用HI表示的平均反应速率为0.1mol•L-1•min-1
(4)丙容器中:反应开始时V正大于V逆(填“小于”、“等于”或“大于”)
 ,其反应类型为取代反应.
,其反应类型为取代反应. .
.