��Ŀ����
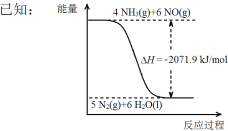
����Ŀ��ijѧϰС�����ݷ�Ӧ��SO2��g��+Cl2��g��![]() SO2Cl2��g����H<0������Ʊ�������SO2Cl2��װ����ͼ��
SO2Cl2��g����H<0������Ʊ�������SO2Cl2��װ����ͼ��

�й���Ϣ�����ʾ��
SO2Cl2 | Cl2 | SO2 | |
�۵�/�� | -54.1 | -101 | -72.4 |
�е�/�� | 69.1 | -34.6 | -10 |
���� | ��ˮ��������ˮ�� | / | / |
(1)����Ũ�������������Ϊԭ����ȡCl2����Ӧ�Ļ�ѧ����ʽΪ ______��
(2)B������������ ______��
(3)Ϊ�˱��ڻ����ķ�������߷�Ӧ���ת���ʣ�Aװ�õķ�Ӧ�������ѡ�� ______��
a.��ˮԡ b.���� c.������69.1��
(4)���ͨ���Cl2��SO2����ˮ�����������Ͷ���������ܷ�����Ӧ�Ļ�ѧ����ʽΪ ______ ��
(5)ʵ��ʱ��ͨ������Cl2��Aװ���еĿ������ߣ��ٻ���ͨ������SO2����������Ӧ����ַ�Ӧ����ͨ��Cl2ʹװ���е�SO2�����ձ��б����ա������������õ�SO2Cl2�м�ˮ�����ְ����������õõ���ɫ��ҺW��
�پ�����SO2Cl2��H2O��Ӧ���ڷ�������ԭ��Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ_________________��
����ɫ��ҺW�е������ӳ�������OH-�⣬�������������������ӣ�������ҺW�������������ӷ�����______��
�۷�Ӧ��ɺ���W��Һ���ձ��зֱ�μӹ�����BaCl2��Һ�������ְ�ɫ�������˳���������ϡ���ᣬ�����ˡ�ϴ�ӡ���������õ��Ĺ��������ֱ�ΪXg��Yg������SO2+Cl2![]() SO2Cl2��Ӧ�У�SO2��ת����Ϊ_____(�ú�X��Y�Ĵ���ʽ��ʾ)��
SO2Cl2��Ӧ�У�SO2��ת����Ϊ_____(�ú�X��Y�Ĵ���ʽ��ʾ)��
���𰸡���1��MnO2+ 4HCl��Ũ��![]() MnCl2+ Cl2��+ 2H2O
MnCl2+ Cl2��+ 2H2O
��2������SO2Cl2��3��a
��4��SO2+Cl2+2H2O![]() H2SO4+2HCl
H2SO4+2HCl
��5���� SO2Cl2��2H2O![]() H2SO4��2HCl
H2SO4��2HCl
��ȡ����W��Һ���Թ��У��������Ba(NO3)2��Һ���в�����ϡ����İ�ɫ����������˵����Һ�к���SO42�����ˣ�����Һ�еμ�HNO3�ữ���ټ���AgNO3��Һ��������ɫ��������˵����Һ����Cl
��6��![]()
��������
������ͼȷ��B�����������ã�Ϊ�˱������ʵķ��룬�������������ʵ��۷е㣬��ƽ��Ƕȣ��¶�Խ��Խ������SO2Cl2���ɣ�ѡ���ˮԡ�����ڷ���SO2Cl2����5��ͨ���SO2������ת��ΪSO2Cl2�����ֱ���Һ���գ����SO2Cl2�����ʣ���ˮ��Ӧ�ķ���ʽ��ʾΪSO2Cl2��2H2O![]() H2SO4��2HCl������W��Һ�г��˻���OH-,������Cl-��SO42-������ķ���Ϊ��ȡ����W��Һ���Թ��У��������Ba(NO3)2��Һ���в�����ϡ����İ�ɫ����������˵����Һ�к���SO42�����ˣ�����Һ�еμ�HNO3�ữ���ټ���AgNO3��Һ��������ɫ��������˵����Һ����Cl����W��Һ���ձ�����Һ�μӹ�����BaCl2��Һ��������BaSO4��������Ԫ���غ㣬SO2Cl2��S��ȫת��ΪBaSO4����ϵΪS ~ BaSO4���ձ��е�SO2�ȱ���������ΪSO42-,��ת��ΪBaSO4����ϵ��ΪS
H2SO4��2HCl������W��Һ�г��˻���OH-,������Cl-��SO42-������ķ���Ϊ��ȡ����W��Һ���Թ��У��������Ba(NO3)2��Һ���в�����ϡ����İ�ɫ����������˵����Һ�к���SO42�����ˣ�����Һ�еμ�HNO3�ữ���ټ���AgNO3��Һ��������ɫ��������˵����Һ����Cl����W��Һ���ձ�����Һ�μӹ�����BaCl2��Һ��������BaSO4��������Ԫ���غ㣬SO2Cl2��S��ȫת��ΪBaSO4����ϵΪS ~ BaSO4���ձ��е�SO2�ȱ���������ΪSO42-,��ת��ΪBaSO4����ϵ��ΪS![]() BaSO4������SO2������Ϊ(X+Y)/233g/mol,ת��ΪSO2Cl2��SO2����ΪX/233g/mol,����������ת����Ϊ
BaSO4������SO2������Ϊ(X+Y)/233g/mol,ת��ΪSO2Cl2��SO2����ΪX/233g/mol,����������ת����Ϊ![]() ��
��

����Ŀ��ȡ0.55mol/L��NaOH��Һ50mL��0.25mol/L������50mL������ͼ��ʾ��װ���н����к��ȵIJⶨʵ�顣�ش��������⣺

��1����ͼ��ʵ��װ�ÿ���������ȱ�ٵ�һ�ֲ�����Ʒ��______________������֮�⣬װ���е�һ�����Դ�����_____________________________��
��2��Ϊ��֤��ʵ��ɹ���ͬѧ��ȡ�������ʩ����ͼ������ĭ���ϵ���������____________________________________��
��3��ʵ���������±���
������д�±��еĿհף�
�¶� ʵ����� | ��ʼ�¶�t1������ | ��ֹ�¶�t2������ | �¶Ȳ�ƽ��ֵ (t2��t1)������ | ||
H2SO4 | NaOH | ƽ��ֵ | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | ___________ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
�ڽ�����Ϊʵ��������Һ���ܶȶ���1 g/cm3���кͺ���Һ�ı�����c��4.18 J/(g����)������ʵ����д��NaOH��Һ��HCl��Һ��Ӧ���Ȼ�ѧ����ʽ(����������һλС��)��_______________��
������ʵ����ֵ�����57.3 kJ/mol��ƫ�����ƫ���ԭ�������(����ĸ)________��
a��ʵ��װ�ñ��¡�����Ч����
b�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
��4������ú�0.5mol Ba(OH)2��ϡ��Һ������ϡ������Һ��Ӧ����Ӧ�ų�����____57.3 kJ����������������С������������������