题目内容
已知氯化钠样品中含有少量的Na2SO4和 Na2CO3,某校化学实验小组的同学计如下流程进行提纯净化实验.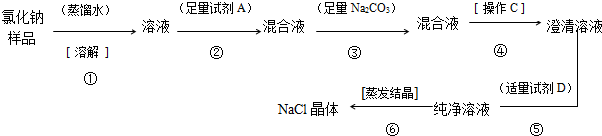
根据流程回答下列问题:
(1)写出下列试剂的化学式及操作C的名称:
试剂A
(2)试剂A和试剂Na2CO3加入的先后顺序能否调换?
(3)加入试剂D的作用是
(4)写出下列步骤反应的化学方程式:
第③步
第⑤步
分析:要除去氯化钠晶体中含有少量的Na2SO4和 Na2CO3两种杂质,实质就是除去碳酸根和硫酸根,结合实验流程可知,首先要溶于水配制成溶液,溶液中含有碳酸钠,硫酸钠和氯化钠三种物质,第二步是向溶液中加入过量的氯化钡(试剂A),把溶液中的碳酸根和硫酸根都转化成沉淀,第三步是加入过量的碳酸钠,把第二步中过量的氯化钡除去,这样得到的混合液中含有碳酸钡和硫酸钡沉淀还要碳酸钠和氯化钠溶液,第四步是过滤除去沉淀,则操作C为过滤;第五步向滤液中加入适量的盐酸(试剂C),除去过量的碳酸钠,得到纯净的氯化钠溶液,第六步再蒸发结晶便得到纯净的氯化钠晶体,以此来解答.
解答:解:结合实验流程可知,首先要溶于水配制成溶液,溶液中含有碳酸钠,硫酸钠和氯化钠三种物质,第二步是向溶液中加入过量的氯化钡(试剂A),把溶液中的碳酸根和硫酸根都转化成沉淀,第三步是加入过量的碳酸钠,把第二步中过量的氯化钡除去,这样得到的混合液中含有碳酸钡和硫酸钡沉淀还要碳酸钠和氯化钠溶液,第四步是过滤除去沉淀,则操作C为过滤;第五步向滤液中加入适量的盐酸(试剂C),除去过量的碳酸钠,得到纯净的氯化钠溶液,第六步再蒸发结晶便得到纯净的氯化钠晶体,
(1)由上述分析可知,试剂A为BaCl2,试剂D为HCl,操作C为过滤,故答案为:BaCl2;HCl;过滤;
(2)试剂A和试剂Na2CO3加入的先后顺序若调换,则除去剩余的BaCl2,
故答案为:不能;因为第②步剩余的BaCl2要由第③步加入的Na2CO3除去,如先后顺序调换,则不能除去剩余的BaCl2;
(3)试剂D的作用是除去第③步剩余的Na2CO3,当溶液不再产生气泡可判断加入试剂D基本达到适量要求,故答案为:除去第③步剩余的Na2CO3;溶液不再产生气泡;
(4)第③步反应为BaCl2+Na2CO3=BaCO3↓+2NaCl,第⑤步反应为Na2CO3+2HCl=2NaCl+H2O+CO2↑,
故答案为:BaCl2+Na2CO3=BaCO3↓+2NaCl;Na2CO3+2HCl=2NaCl+H2O+CO2↑.
(1)由上述分析可知,试剂A为BaCl2,试剂D为HCl,操作C为过滤,故答案为:BaCl2;HCl;过滤;
(2)试剂A和试剂Na2CO3加入的先后顺序若调换,则除去剩余的BaCl2,
故答案为:不能;因为第②步剩余的BaCl2要由第③步加入的Na2CO3除去,如先后顺序调换,则不能除去剩余的BaCl2;
(3)试剂D的作用是除去第③步剩余的Na2CO3,当溶液不再产生气泡可判断加入试剂D基本达到适量要求,故答案为:除去第③步剩余的Na2CO3;溶液不再产生气泡;
(4)第③步反应为BaCl2+Na2CO3=BaCO3↓+2NaCl,第⑤步反应为Na2CO3+2HCl=2NaCl+H2O+CO2↑,
故答案为:BaCl2+Na2CO3=BaCO3↓+2NaCl;Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评:本题考查物质分离、提纯实验方案的设计,把握流程中所选用除杂和净化的方法、发生的化学反应为解答的关键,注意除去杂质不要引入新的杂质,对于实验过程中过量的试剂都要除去,明确试剂加入的先后顺序,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目