题目内容
某学生用质量为a g、边长为b cm的正方形镀锌铁片与过量盐酸反应测定镀层厚度,并将实验结果绘图示意,反应完毕后铁片质量为c g(已知锌的密度为ρ g/cm3)。下列叙述错误的是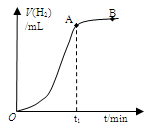
| A.t1时刻锌镀层已完全反应 |
B.锌镀层的厚度为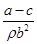 |
| C.反应放热也是影响OA段的反应速率的因素之一 |
| D.有原电池反应发生,正极的电极反应式为Zn - 2e → Zn2+ |
BD
解析试题分析:A、锌活泼性强,且形成原电池反应速率快,其反应结束时铁与稀盐酸反应速率慢,正确;B、该实验原理是根据产生氢气的速率变化确定锌反应完成,根据铁片前后质量变化得出金属锌的质量,再有铁皮面积计算锌镀层的厚度,要注意铁片两面镀锌,故结果是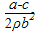 ,错误;C、金属与酸反应放热,反应速率加快,正确;D、有原电池反应发生,负极的电极反应式为Zn - 2e → Zn2+,错误。
,错误;C、金属与酸反应放热,反应速率加快,正确;D、有原电池反应发生,负极的电极反应式为Zn - 2e → Zn2+,错误。
考点:考查实验测定与结果分析等有关问题。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是:
| A.试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
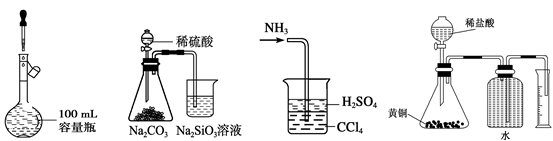
下列有关实验装置的说法,正确的是 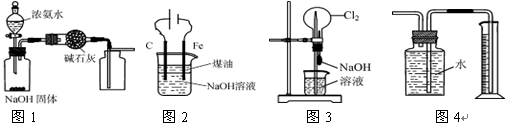
| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置制备Fe(OH)2并能较长时间观察其颜色 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与浓硝酸反应产生气体的体积 |
下述实验方案能达到实验目的的是
| 编号 | A | B | C | D |
| 实验 方案 |  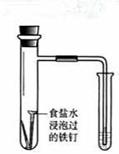 食盐水 | 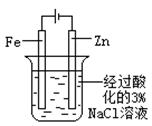 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 | 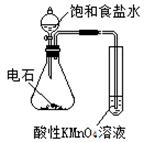 | 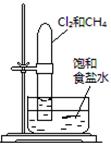 置于光亮处 |
| 实验 目的 | 验证铁钉发生 析氢腐蚀 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
下列家庭化学小实验不能达到预期目的的是
| A.用米汤检验食用加碘盐中含有碘 |
| B.用醋、石灰水验证蛋壳中含有碳酸盐 |
| C.用碘酒检验汽油中是否含有不饱和烃 |
| D.用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
下列实验操作及现象能够达到对应实验目的的是
| | 实验内容 | 实验目的 |
| A | 将SO2通入品红溶液中,品红褪色;加热褪色后品红溶液,溶液恢复红色 | 证明亚硫酸的不稳定性 |
| B | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有少量气泡产生 | 证明常温下KSP(BaSO4)>KSP(BaCO3) |
| C | 常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 将浓硫酸和碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中CO2的存在 |
根据下列实验现象,所得结论正确的是( )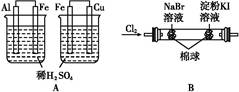
| 实验 | 实验现象 | 结论 |
| A | 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 金属活动性:Al>Fe>Cu |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 白色固体先变为淡黄色,后变为黑色 | 溶解性:AgCl<AgBr<Ag2S |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
 A.定容
A.定容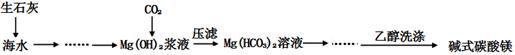
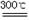 (x+y)MgO+xCO2↑+(y+z)H2O
(x+y)MgO+xCO2↑+(y+z)H2O