题目内容
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置: 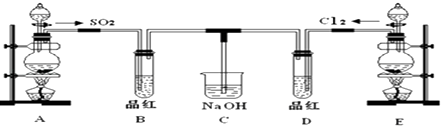
(1)用装置E制备Cl2 , 其反应的化学方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O.若有0.2mol HCl被氧化,则转移的电子总数为 .
MnCl2+Cl2↑+2H2O.若有0.2mol HCl被氧化,则转移的电子总数为 .
(2)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是: . ②停止通气后,再给B、D两个试管分别加热;两个试管中的现象分别为:B: , D: .
(3)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样.请你分析该现象的原因(用化学方程式表示) .
【答案】
(1)0.2NA
(2)品红褪色、品红褪色;由无色变为红色;无明显现象
(3)SO2+Cl2+2H2O=H2SO4+2HCl
【解析】解:(1)反应MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O中,氯从﹣1价变为0价,每生成1mol氯气,转移电子是2mol,即当2mol电子转移时,消耗盐酸是4mol,被氧化的HCl是2mol,所以若有0.2mol HCl被氧化,则转移的电子总数为0.2mol,即0.2NA , 所以答案是:0.2NA;(2)①氯气和二氧化硫都能是品红溶液褪色,所以B和D装置中品红都褪色, 所以答案是:品红褪色、品红褪色;②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,所以看到的现象是B中溶液由无色变为红色,D中无明显现象,所以答案是:由无色变为红色;无明显现象;(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,生成物都无漂白性;所以答案是:SO2+Cl2+2H2O=H2SO4+2HCl.
MnCl2+Cl2↑+2H2O中,氯从﹣1价变为0价,每生成1mol氯气,转移电子是2mol,即当2mol电子转移时,消耗盐酸是4mol,被氧化的HCl是2mol,所以若有0.2mol HCl被氧化,则转移的电子总数为0.2mol,即0.2NA , 所以答案是:0.2NA;(2)①氯气和二氧化硫都能是品红溶液褪色,所以B和D装置中品红都褪色, 所以答案是:品红褪色、品红褪色;②二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,所以看到的现象是B中溶液由无色变为红色,D中无明显现象,所以答案是:由无色变为红色;无明显现象;(3)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,生成物都无漂白性;所以答案是:SO2+Cl2+2H2O=H2SO4+2HCl.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案