题目内容
【题目】(已知:2 SO2 (g)+O2(g) ![]() 2SO3(g) △H = -196.6 KJ·mol- 1), 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。以下叙述错误的是( )
2SO3(g) △H = -196.6 KJ·mol- 1), 恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。以下叙述错误的是( )
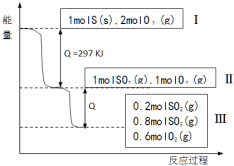
A.表示硫的燃烧热的热化学方程式:S(s)+O2(g)=SO2(g) ΔH=-297 KJ·mol-1
B.由Ⅱ到Ⅲ的过程放出的热量为98.3KJ
C.恒温恒容时,1molSO2和2molO 2 充分反应,放出热量的数值大于78.64KJ
D.将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 2mol
【答案】B
【解析】
试题分析:A.燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol,由图1可知1molS(s)完全燃烧放出的热量为297kJ,所以硫的燃烧热的热化学方程式S(s)+O 2(g)= SO2 (g) ΔH=-297 kJ·mol-1,A正确;B.由图1可知,Ⅱ到Ⅲ的过程参加反应的n(SO2)=1mol-0.2mol= 0.8mol,根据热化学方程式:2SO2(g)+O2(g)![]() 2SO3(g)△H=-196.6kJmol-1,可知由Ⅱ到Ⅲ的过程放出的热量为Q=0.4×196.6kJmol-1=78.64kJmol-1,B错误;C.由B计算可知,由Ⅱ到Ⅲ的过程放出的热量为Q=0.4×196.6kJmol-1=78.64kJmol-1,当恒温恒容时,1molSO2和2molO2 充分反应相当于在Ⅱ的基础上再加入1molO2,平衡向着正反应继续进行,所以放出的热量大于78.64kJ,C正确;D.将Ⅲ中的混合气体通入足量的NaOH溶液中,充分反应后生成Na2SO4,根据硫原子守恒,即生成Na2SO4为1mol,再根据Na原子守恒,可以判定消耗NaOH为2mol,D正确;答案选B。
2SO3(g)△H=-196.6kJmol-1,可知由Ⅱ到Ⅲ的过程放出的热量为Q=0.4×196.6kJmol-1=78.64kJmol-1,B错误;C.由B计算可知,由Ⅱ到Ⅲ的过程放出的热量为Q=0.4×196.6kJmol-1=78.64kJmol-1,当恒温恒容时,1molSO2和2molO2 充分反应相当于在Ⅱ的基础上再加入1molO2,平衡向着正反应继续进行,所以放出的热量大于78.64kJ,C正确;D.将Ⅲ中的混合气体通入足量的NaOH溶液中,充分反应后生成Na2SO4,根据硫原子守恒,即生成Na2SO4为1mol,再根据Na原子守恒,可以判定消耗NaOH为2mol,D正确;答案选B。