题目内容
一定条件下,在容积固定的某密闭容器中发生的反应N2+3H2 2NH3.在10s内N2的浓度由5mol/L降至4mol/L下列说法正确的是( )
2NH3.在10s内N2的浓度由5mol/L降至4mol/L下列说法正确的是( )
 2NH3.在10s内N2的浓度由5mol/L降至4mol/L下列说法正确的是( )
2NH3.在10s内N2的浓度由5mol/L降至4mol/L下列说法正确的是( )分析:A、根据v=
计算v(N2),再利用速率之比等于化学计量数之比计算v(NH3).
B、催化剂改变反应历程,加快反应.
C、温度降低反应速率减小.
D、可逆反应中物质不能100%转化.
| △c |
| △t |
B、催化剂改变反应历程,加快反应.
C、温度降低反应速率减小.
D、可逆反应中物质不能100%转化.
解答:解:A、10s内v(N2)=
=0.1mol/(L?s),速率之比等于化学计量数之比,所以v(NH3)=2v(N2)=0.2mol/(L?s),故A错误;
B、使用合适的催化剂,降低反应活化能,活化分子增多,反应加快,故B正确;
C、增加H2的浓度会加快该反应的速率,降低温度会是反应减慢,故C错误;
D、可逆反应中物质不能100%转化,无论时间多长,N2、H2浓度都不可能为零,故D错误.
故选:B.
| 5mol/L-4mol/L |
| 10s |
B、使用合适的催化剂,降低反应活化能,活化分子增多,反应加快,故B正确;
C、增加H2的浓度会加快该反应的速率,降低温度会是反应减慢,故C错误;
D、可逆反应中物质不能100%转化,无论时间多长,N2、H2浓度都不可能为零,故D错误.
故选:B.
点评:考查可逆反应特点、反应速率计算、外界条件对反应速率的影响,难度不大,注意温度降低反应减慢,与反应是吸热还是放热无关.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
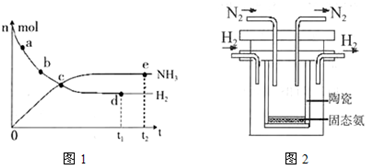
 2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。
2NH3(g)+92.4 kJ/mol673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随时间变化的关系如右图所示。

 2NH3(g)+92.4 kJ/mol
2NH3(g)+92.4 kJ/mol
 2H+,则阴极的电极反应为:_____________。
2H+,则阴极的电极反应为:_____________。
 2Ag(固)+2NO2(气)+O2(气),2NO2(气)
2Ag(固)+2NO2(气)+O2(气),2NO2(气)  N2O4(气),2min末,测得固体减重6.2g,且C(NO2)=0.04mol/L,则下列说法正确的是
( )
N2O4(气),2min末,测得固体减重6.2g,且C(NO2)=0.04mol/L,则下列说法正确的是
( )  2Ag(固)+2NO2(气)+O2(气),2NO2(气)
2Ag(固)+2NO2(气)+O2(气),2NO2(气) N2O4(气),2min末,测得固体减重6.2g,且C(NO2)=0.04mol/L,则下列说法正确的是
N2O4(气),2min末,测得固体减重6.2g,且C(NO2)=0.04mol/L,则下列说法正确的是