题目内容
(2009?海南)已知:Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ?mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
则2Fe(s)+
O2(g)=Fe2O3(s)的△H是( )
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
则2Fe(s)+
| 3 |
| 2 |
分析:根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减,据此判断.
解答:解:已知:(1)Fe2O2(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ?mol-1
(2)C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
由盖斯定律(2)×
-(1),得:2Fe(s)+
O2(g)=Fe2O3(s)△H=(-393.5kJ?mol-1)×
-234.1kJ?mol-1
即2Fe(s)+
O2(g)=Fe2O3(s)△H=-824.35kJ?mol-1.
故选:A.
| 3 |
| 2 |
| 3 |
| 2 |
(2)C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
由盖斯定律(2)×
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
即2Fe(s)+
| 3 |
| 2 |
故选:A.
点评:本题考查盖斯定律的利用,难度不大,明确已知反应与目标热化学方程式的关系是关键,注意基础知识的掌握与理解.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
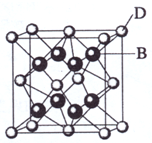 (2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.
(2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.