题目内容
(2009?海南)已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是( )
分析:A.利用氢离子的浓度计算pH;
B.温度升高促进电离,氢离子浓度越大,pH越小;
C.根据电离度及离子的浓度计算电离平衡常数;
D.HA电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度.
B.温度升高促进电离,氢离子浓度越大,pH越小;
C.根据电离度及离子的浓度计算电离平衡常数;
D.HA电离出的c(H+)为0.1mol/L×0.1%,利用Kw来计算水电离产生的氢离子浓度.
解答:解:A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故A正确;
B.温度升高促进弱酸的电离,氢离子浓度变大,则pH变小,故B错误;
C.由HA═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为
=1×10-7,故C正确;
D.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢离子浓度为10-10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故D正确;
故选B.
B.温度升高促进弱酸的电离,氢离子浓度变大,则pH变小,故B错误;
C.由HA═H++Ac-,c(H+)=c(Ac-)=10-4mol/L,则电离平衡常数为
| 10-4×10-4 |
| 0.1 |
D.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,水电离产生的氢离子浓度为10-10mol/L,则由HA电离出的c(H+)约为水电离出的c(H+)的106倍,故D正确;
故选B.
点评:本题考查弱酸的电离,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,难度不大.

练习册系列答案
相关题目
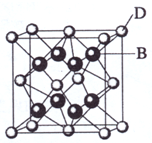 (2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.
(2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.