题目内容
【题目】已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。

(1)B分子中官能团的名称是________,D中官能团的名称是_________;反应①的反应类型是__________反应。
(2)反应②的化学方程式是________________________________________,反应⑤的化学方程式是_________________________________________________。
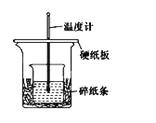
(3)①某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为___________________,其作用是(填字母)_____________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,_____(能/不能)生成1mol 乙酸乙酯,原因是_____________________________________________________。
【答案】 羟基 羧基 加成 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOCH2CH3+NaOH
2CH3CHO+2H2O CH3COOCH2CH3+NaOH![]() CH3COONa+CH3CH2OH 饱和Na2CO3溶液 BC 不能 该反应为可逆反应,有一定的限度,不可能完全转化
CH3COONa+CH3CH2OH 饱和Na2CO3溶液 BC 不能 该反应为可逆反应,有一定的限度,不可能完全转化
【解析】分析:有机物A的产量可以用来衡量一个国家的石油化工发展水平,A是乙烯。乙烯与水发生加成反应生成B是乙醇,乙醇发生催化氧化生成C是乙醛,乙醛发生氧化反应生成D是乙酸,乙酸与乙醇发生酯化反应生成E是乙酸乙酯,乙酸乙酯在氢氧化钠溶液中水解生成乙醇和F乙酸钠,据此解答。
详解:根据以上分析可知A是乙烯,B是乙醇,C是乙醛,D是乙酸,E是乙酸乙酯,F是醋酸钠。则
(1)B是乙醇,分子中官能团的名称是羟基,D是乙酸,分子中官能团的名称是羧基;反应①是乙醇与水的加成反应。
(2)反应②是乙醇的催化氧化,反应的化学方程式是2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应⑤是乙酸乙酯的水解反应,反应的化学方程式是CH3COOCH2CH3+NaOH
2CH3CHO+2H2O,反应⑤是乙酸乙酯的水解反应,反应的化学方程式是CH3COOCH2CH3+NaOH![]() CH3COONa+CH3CH2OH。
CH3COONa+CH3CH2OH。
(3)①由于生成的乙酸乙酯中含有乙酸和乙醇,因此需要利用饱和碳酸钠溶液除杂,其主要作用是中和乙酸并吸收部分乙醇、降低乙酸乙酯的溶解度,便于分层析出,答案选BC;
②由于酯化反应是可逆反应,有一定的限度,不可能完全转化,所以用1mol B和1mol D充分反应,不能生成1mol 乙酸乙酯。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验KIO3中的碘元素 | 取少量KIO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 |
B | 检验石油裂解气中的乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
C | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH计测定饱和的NaClO溶液和饱和的 |
D | 硅酸胶体的制备 | 向 |
A.AB.BC.CD.D