题目内容
6.硝酸铈铵[(NH4)2Ce(NO3)6]广泛应用于电子、催化工业,其合成路线如下:(1)已知(NH4)2Ce(NO3)6受热易分解,某科研小组认为反应原理如下,请补充完整:

(NH4)2Ce(NO3)6$\frac{\underline{\;\;△\;\;}}{\;}$CeO2•8OH+8NO↑; CeO2•8OH $\frac{\underline{\;\;△\;\;}}{\;}$CeO2+4H2O↑+2O2↑(请补充完整).
除去 NO中的NO2的方法是水洗.
(2)步骤Ⅰ中,将Ce(NO3)3•6H2O配成溶液,保持pH到4~5,缓慢加入H2O2溶液搅拌混合均匀,再加入氨水调节溶液pH,得到Ce(OH)4沉淀.该过程中每生成1molCe(OH)4,参加反应的氧化剂的物质的量为0.5mol.
(3)常温下,某同学向物质的量浓度均为1.0mol•L-1的Fe3+和Ce4+的混合溶液中滴加氢氧化钠溶液,先析出的沉淀Fe(OH)3(填化学式),当调节溶液的pH为8时,溶液中c(Ce4+):c(Fe)=1:1.{已知298K时,Ksp[Ce(OH)4]=1×10-29.Ksp[Fe(OH)3]=4×10-38.}
(4)为了研究步骤Ⅲ的工艺条件,科研小组测定了(NH4)2Ce(NO3)6在不同温度、不同浓度硝酸中的溶解度,结果如图2.从图2中可得出三条主要规律:
①其他条件相同时,NH4)2Ce(NO3)6在的溶解度随c(HNO3)增大而减小;
②(NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;
③c(HNO3)越小,温度对S的影响越大或c(HNO3)越大,温度对S的影响越小.

分析 (1)根据质量守恒可确定未知物分子式应为O2,一氧化氮(NO)气体难溶于水,NO2和水反应生成NO和硝酸;
(2)Ge元素化合价由+3价升高到+4价,被氧化,Ce(NO3)3•6H2O为还原剂,该过程中每生成1molCe(OH)4,转移1mol电子,H2O2为氧化剂,O元素化合价由-1价降低到-2价,根据得失电子守恒可确定参加反应的氧化剂的物质的量;
(3)化学式相似的物质的溶度积常数越小,物质越难溶,根据沉淀的转化、生成和溶解平衡的角度解答,当调节溶液的pH为8时,c(OH-)=1×10-6mol/L,根据溶度积定义书写表达式,结合溶度积计算离子浓度比;
(4)根据曲线的变化趋势判断温度、浓度对溶解度的影响.
解答 解:(1)由质量守恒定律可知反应的方程式应为CeO2•8OH$\frac{\underline{\;\;△\;\;}}{\;}$CeO2+4H2O↑+2O2↑,生成的未知物质为O2,NO2和水反应:3NO2+H2O=2HNO3+NO,生成NO和硝酸,所以通过水洗可除去NO中的NO2,
故答案为:2O2;水洗;
(2)Ge元素化合价由+3价升高到+4价,被氧化,Ce(NO3)3•6H2O为还原剂,H2O2为氧化剂,O元素化合价由-1价降低到-2价,由化合价升降总数相等可知氧化剂和还原剂的物质的量之比应为1:2,该过程中每生成1molCe(OH)4,则参加反应的氧化剂H2O2为0.5mol,
故答案为:0.5mol;
(3)298K时,Ksp[Ce(OH)4]=1×10-29.Ksp[Fe(OH)3]=4×10-38,根据化学式相似的物质的溶度积常数越小,物质越难溶可知常温下在水中溶解能力Ce(OH)4>Fe(OH)3,向物质的量浓度均为1.0mol•L-1的Fe3+和Ce4+的混合溶液中滴加氢氧化钠溶液,先析出的沉淀Fe(OH)3,当调节溶液的pH为8时,c(OH-)=1×10-6mol/L,c(Fe3+)•(OH-)3=1.0×1.0×10-18=1×10-18>Ksp[Fe(OH)3],铁离子已沉淀完全,残留在溶液中的铁离子物质的量浓度低于1.0×10-5mol•L-1,Ce(OH)4的溶度积表达式为c(Ce4+)•[c(OH-)]4=1.0×1.0×10-24=1×10-24>Ksp[Ce(OH)4],Ce4+已沉淀完全,残留在溶液中的Ce4+物质的量浓度低于1.0×10-5mol•L-1,所以两者之比为1:1,
故答案为:Fe(OH)3;1:1;
(4)由曲线的变化趋势可得出规律有:
①其它条件相同时,S随c(HNO3)增大而减小;
②(NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;
③c(HNO3)越小,温度对S的影响越大或c(HNO3)越大,温度对S的影响越小.
故答案为:(NH4)2Ce(NO3)6在硝酸中的溶解度随温度升高而增大;c(HNO3)越小,温度对S的影响越大或c(HNO3)越大,温度对S的影响越小.
点评 本题考查物质的制备方案的设计,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力和计算能力的考查,注意从守恒的角度解答相关计算,把握难溶电解质的溶解特点,题目难度中等.

| A. | X气体是F3O2,它具有还原性 | |
| B. | X气体是OF2,它具有氧化性 | |
| C. | 在F2与NaOH反应时,F2既是氧化剂又是还原剂 | |
| D. | 在反应中还有NaFO生成 |
| A. | KCl | B. | SiO2 | C. | HNO3 | D. | Fe |
| A. | 小于7 | B. | 等于7 | C. | 大于7 |
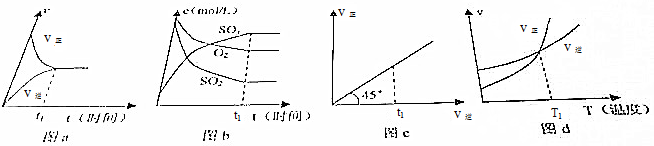
| A. | 只有图a和图b | B. | 只有图a和图d | ||
| C. | 只有图a、图b和图d | D. | 图a、图b、图c和图d都是 |
| A. | 一氧化碳、二氧化氮、一氧化氮都是大气污染物,在空气中都能稳定存在 | |
| B. | 高锰酸钾或重铬酸钾不能与草酸或铝粉存放在同一个药品柜里 | |
| C. | 二氧化硅、五氧化二磷都是酸性氧化物,都与水反应生成相应的含氧酸 | |
| D. | 氧化钠、氢氧化钠、都是含氧化合物,与水反应产物相同 |
| A. | 10g H2和10g N2 | B. | 22gCO2和3.01×1023个O2 | ||
| C. | 3.2g O2和2.24L的空气 | D. | 1mol H2O和1g H2O |
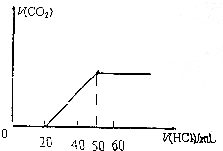 Ⅰ.取10mL密度1.20g/cm3、质量分数36.5%的y盐酸,加水稀释至300mL,则稀释后盐酸的物质的量浓度是0.4mol/L;
Ⅰ.取10mL密度1.20g/cm3、质量分数36.5%的y盐酸,加水稀释至300mL,则稀释后盐酸的物质的量浓度是0.4mol/L;