题目内容
对于固定体积的密闭容器中进行的气体反应A(g) + B(g) ![]() C(g) + D(g),可以说明在恒温下该反应已达到平衡的是
C(g) + D(g),可以说明在恒温下该反应已达到平衡的是
A.反应容器的压强不随时间而变化 B.A气体和B气体的生成速率相等
C.A气体和C气体的生成速率相等 D.反应混合气体的密度不随时间而变化
C
解析:因为反应前后体积不变,所以压强恒定,A不能说明。A气体和B气体的生成速率方向是一致的,不能说明。但A气体和C气体的生成速率方向是相反,且满足速率之比是化学计量数之比,正确。密度是混合气的质量和容器容积的比值,由于质量和容器容积始终不变,所以密度是不变的。答案是C。

练习册系列答案
相关题目
将E和F加入固定容积的密闭容器中,在一定条件下发生反应:
E(g)+F(s)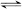 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
|
压强/MPa 体积分数/% 温度/℃ |
1.0 |
2.0 |
3.0 |
|
810 |
54.0 |
a |
b |
|
915 |
c |
75.0 |
d |
|
1000 |
e |
f |
83.0 |
(1)915℃、2.0MPa时E的转化率为 。
(2)该反应的△S 0(填“>”、“<”或“=”,下同),b f。
(3)平衡常数K(1000℃) K(810℃) ,理由是 。
(4)对于上述反应,下列说法正确的是 (填序号)。
①混合气体的密度不再变化,反应达到平衡
②该反应的正反应为放热反应
③增大F的量,单位体积活化分子数增大,化学反应速率加快
④恒温恒容条件下通入惰性气体,平衡不移动
⑤恒温恒压条件下通入惰性气体,化学反应速率加快
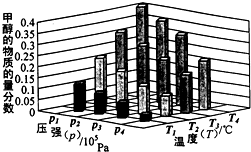 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.






 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)