题目内容
将E和F加入固定容积的密闭容器中,在一定条件下发生反应:
E(g)+F(s) 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
|
压强/MPa 体积分数/% 温度/℃ |
1.0 |
2.0 |
3.0 |
|
810 |
54.0 |
a |
b |
|
915 |
c |
75.0 |
d |
|
1000 |
e |
f |
83.0 |
(1)915℃、2.0MPa时E的转化率为 。
(2)该反应的△S 0(填“>”、“<”或“=”,下同),b f。
(3)平衡常数K(1000℃) K(810℃) ,理由是 。
(4)对于上述反应,下列说法正确的是 (填序号)。
①混合气体的密度不再变化,反应达到平衡
②该反应的正反应为放热反应
③增大F的量,单位体积活化分子数增大,化学反应速率加快
④恒温恒容条件下通入惰性气体,平衡不移动
⑤恒温恒压条件下通入惰性气体,化学反应速率加快
(1)60%(2分)
(2)>(1分);<(1分)
(3)>(1分);
该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大(1分)
(4)①④(2分,漏选得1分,错选不得分);
【解析】
试题分析:(1)假设一开始加入的E的物质的量为amol
E(g) +
F(s)  2G(g)
2G(g)
起始: amol 0mol
变化: bmol 2bmol
平衡:(a-b)mol 2bmol
依题意有: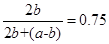
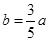
915℃、2.0MPa时E的转化率为:60%
(2)该反应中由1mol的E生成2mol 的F,也就是说是一个熵增的方向,因此△S >0(1分);第二个空中使用控制变量法,先比较a和b的大小,对于这个反应来讲,温度一定条件下,压强越大,转化率越小,因此有: b <a<54℅,那么从表中可以看出,在二个大气压下,从上到下,随温度的升高,数值应该是越来越大,因此有b <a<54℅<75℅<f 。(3)从上到下温度越来越高,G的含量越来越大,意味着温度升高,平衡正向移动,表明正向是一个吸热的方向,因此平衡常数K(1000℃)> K(810℃);
(4)①混合气体的密度不再变化,那么反应物F的量不再变化,意味着各反应物和生成物的浓度都不再变化成了一定值,反应达到平衡,正确;②该反应的正反应为吸热反应,错误;③增大F的量,F是固体,浓度是定值,不会使得单位体积活化分子数增大,化学反应速率不变,错误;④恒温恒容条件下通入惰性气体,不改变各物质的浓度,平衡不移动,正确;⑤恒温恒压条件下通入惰性气体,各组分的浓度不变,化学反应速率不变,错误。
考点:考查化学平衡的有关知识。

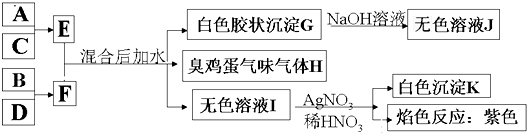
 2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=
2BO3,在一个固定容积为2L的密闭容器中充入0.20mol的BO2和0.10mol的O2,半分钟后达到平衡,测得容器中含BO3为0.18mol,则v(o2 )=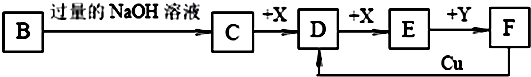
 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为 (用m、n表示;设A、B、C和D、E、F之间均不发生反应)。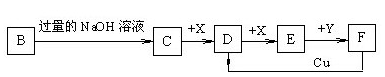
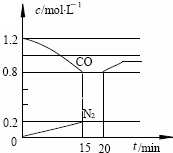
 N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。
N2(g) + 2CO2(g);△H<0。若在一定温度下,将1.4 mol D、1.2 mol CO充入1 L固定容积的容器中,反应过程中各物质的浓度变化如图所示。