题目内容
 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜[Cu(NH3)2]AC溶液(AC=CH3COO-)来吸收合成气中的一氧化碳,其反应原理为:[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC?CO(aq)△H<0常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC溶液的措施是
(2)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol;反应b:CO(g)+2H2(g)?CH3OH(g)△H<0
①对于反应a,某温度下,将4.0mol CO2(g)和12.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为
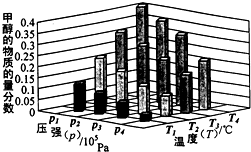
②对于反应b,某温度下,将1.0mol CO(g)和2.0mol H2(g)充入固定容积的密闭容器中,反应到达平衡时,改变温度和压强,平衡体系中CH3OH的物质的量分数变化情况如图所示,于温和压强的关系判断正确的是
A.p3>p2,T3>T2 B.p2>p4,T4>T2 C.p1>p3,T1>T3 D.p1>p4,T2>T3
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是
A.逆反应速率先增大后减小
B.反应物的体积百分含量减小
C.正反应速率先增大后减小
D.化学平衡常数K值增大
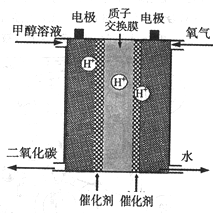
②写出二甲醚碱性燃料电池的负极电极反应式
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知lg二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ,请写出表示二甲醚燃烧热的热化学方程式
分析:(1)根据反应[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC?CO(aq)△H<0为放热反应及温度对化学平衡的影响进行解答;
(2)①设出达到平衡时甲醇的物质的量,然后根据达到平衡时甲醇的百分含量计算出达到平衡时各组分的物质的量及浓度,最后带人K=
计算出该温度下该反应的平衡常数;
②根据温度和压强对化学平衡的影响进行判断各温度和压强大小;
(3)①根据影响化学平衡的因素进行判断满足“平衡一定向正反应方向移动”的选项;
②原电池负极发生氧化反应,二甲醚在碱性条件下失去电子生成碳酸根离子和水,据此写出电极反应;
③根据乙醇和二甲醚中结构简式不同,发生反应时断裂的化学键不同,反应放出的能量不会相同,据此进行判断;
(4)根据lg二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ计算出1mol二甲醚完全燃烧放出的热量,然后根据热化学方程式的书写方法写出二甲醚燃烧热的热化学方程式.
(2)①设出达到平衡时甲醇的物质的量,然后根据达到平衡时甲醇的百分含量计算出达到平衡时各组分的物质的量及浓度,最后带人K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c(H2)3 |
②根据温度和压强对化学平衡的影响进行判断各温度和压强大小;
(3)①根据影响化学平衡的因素进行判断满足“平衡一定向正反应方向移动”的选项;
②原电池负极发生氧化反应,二甲醚在碱性条件下失去电子生成碳酸根离子和水,据此写出电极反应;
③根据乙醇和二甲醚中结构简式不同,发生反应时断裂的化学键不同,反应放出的能量不会相同,据此进行判断;
(4)根据lg二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ计算出1mol二甲醚完全燃烧放出的热量,然后根据热化学方程式的书写方法写出二甲醚燃烧热的热化学方程式.
解答:解:(1)[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)?[Cu(NH3)3]AC?CO(aq)△H<0,该反应为放热反应,升高温度,平衡向着逆向移动,可以将吸收一氧化碳的溶液处理重新获得[Cu(NH3)2]AC,
故答案为:加热;
(2)①按反应a充分反应达到平衡后,设n(CH3OH)=xmol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)(g)
起始量(mol) 4 12 0 0
变化量(mol) x 3x x x
平衡量(mol) 4-x 12-3x x x
达到平衡时甲醇的含量为:
×100%=30%,
解得:x=3,达到平衡时各组分的浓度为:c(CO2)=
mol/L=0.5mol/L,c(H2)=
mol/L=1.5mol/L,c(CH3OH)=c(H2O)=
=1.5mol/L,
则该温度下反应的平衡常数为:K=
=
=
≈1.33,
故答案为:1.33或
;
②对于反应:CO(g)+2H2(g)?CH3OH(g)△H<0,温度相同时,压强越大,平衡向着正向移动,甲醇的物质的量分数则越大,则:P1>P2>P3>P4;压强相同时,温度越高,平衡向着逆向移动,甲醇的物质的量分数越小,则:T1>T2>T3>T4;所以P1>P3、T1>T3,P1>P4、T2>T3,所以A、B错误,CD正确,
故答案为:CD;
(3)①A.逆反应速率先增大后减小,可以升高温度,正逆反应速率都增大,平衡向着逆向移动,满足了逆反应速率先增大后逐渐减小,故A错误;
B.反应物的体积百分含量减小,如减少反应物浓度,平衡会向着逆向移动,故B错误;
C.正反应速率先增大后减小,说明是增大了压强或增加反应物浓度,无论改变说明条件,平衡一定向着正向移动,故C正确;
D.化学平衡常数K值增大,说明生成物的浓度增大,反应物的浓度减小,平衡一定向着正向移动,故D正确;
故答案为:CD;
②二甲醚在碱性燃料电池的负极失去电子生成碳酸根离子和水,电极反应为CH3OCH3-12e-+16OH-═2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
③化学反应实质是旧键的断裂和新键的生成,放出的能量与旧键断裂吸收的能量和新键的生成放出的能量有关,而二甲醚和乙醇分子中化学键类型不同,所以反应过程中放出的能量不同,所以C正确,
故答案为:C;
(4)1mol二甲醚的质量为46g,46g二甲醚完全燃烧生成稳定氧化物放出的热量为:31.63kJ×46g=1454.98 kJ,所以二甲醚燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol,
故答案为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol.
故答案为:加热;
(2)①按反应a充分反应达到平衡后,设n(CH3OH)=xmol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)(g)
起始量(mol) 4 12 0 0
变化量(mol) x 3x x x
平衡量(mol) 4-x 12-3x x x
达到平衡时甲醇的含量为:
| x |
| (4-x)+(12-3x)+x+x |
解得:x=3,达到平衡时各组分的浓度为:c(CO2)=
| 4-3 |
| 2 |
| 12-9 |
| 2 |
| 3mol |
| 2L |
则该温度下反应的平衡常数为:K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c(H2)3 |
| 1.5×1.5 |
| 0.5×1.53 |
| 4 |
| 3 |
故答案为:1.33或
| 4 |
| 3 |
②对于反应:CO(g)+2H2(g)?CH3OH(g)△H<0,温度相同时,压强越大,平衡向着正向移动,甲醇的物质的量分数则越大,则:P1>P2>P3>P4;压强相同时,温度越高,平衡向着逆向移动,甲醇的物质的量分数越小,则:T1>T2>T3>T4;所以P1>P3、T1>T3,P1>P4、T2>T3,所以A、B错误,CD正确,
故答案为:CD;
(3)①A.逆反应速率先增大后减小,可以升高温度,正逆反应速率都增大,平衡向着逆向移动,满足了逆反应速率先增大后逐渐减小,故A错误;
B.反应物的体积百分含量减小,如减少反应物浓度,平衡会向着逆向移动,故B错误;
C.正反应速率先增大后减小,说明是增大了压强或增加反应物浓度,无论改变说明条件,平衡一定向着正向移动,故C正确;
D.化学平衡常数K值增大,说明生成物的浓度增大,反应物的浓度减小,平衡一定向着正向移动,故D正确;
故答案为:CD;
②二甲醚在碱性燃料电池的负极失去电子生成碳酸根离子和水,电极反应为CH3OCH3-12e-+16OH-═2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
③化学反应实质是旧键的断裂和新键的生成,放出的能量与旧键断裂吸收的能量和新键的生成放出的能量有关,而二甲醚和乙醇分子中化学键类型不同,所以反应过程中放出的能量不同,所以C正确,
故答案为:C;
(4)1mol二甲醚的质量为46g,46g二甲醚完全燃烧生成稳定氧化物放出的热量为:31.63kJ×46g=1454.98 kJ,所以二甲醚燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol,
故答案为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol.
点评:本题考查了化学平衡的调控作用、化学平衡的影响因素、原电池工作原理及电极反应的书写、化学平衡常数的计算、化学平衡状态的判断等知识,题目难度较大,考查的知识点较大,充分考查了学生对化学平衡、原电池工作原理等知识的掌握情况,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 [Cu(NH3)3]Ac•CO(aq)(△H<0)
[Cu(NH3)3]Ac•CO(aq)(△H<0)